Unterschied zwischen Emissions- und Absorptionsspektren
- 2414
- 141
- Leonhard Lesch

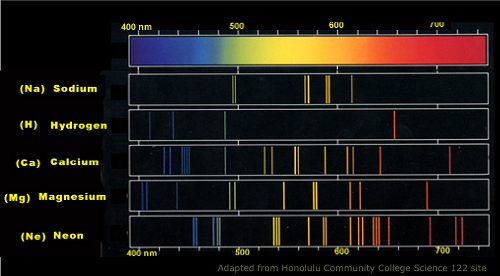
Natriumatomemissionsspektrum
Emission vs. Absorptionsspektren
Ein Chemiker, der darauf abzielt, die elementare Zusammensetzung einer bestimmten Substanz oder Lösung zu ermitteln, kann die Atome durch Emissions- und/oder Absorptionsspektroskopie unterscheiden. Beide Prozesse sind auf die Beobachtung der Elektronen und Photonen ausgerichtet, wenn sie Licht ausgesetzt werden. In diesen Prozessen wird dann ein Spektrophotometer zusammen mit einer Lichtquelle benötigt. Der Wissenschaftler muss eine Liste von Werten für beide Absorptionsemissionen für jedes Atom haben.
Wenn der Wissenschaftler beispielsweise eine Stichprobe aus einem weit entfernten Bereich entdeckt und die Zusammensetzung der Angelegenheit erlernen möchte, kann er die Probe der Emissions- oder Absorptionsspektroskopie aussetzen. In den Absorptionsspektren soll er beobachten, wie die Elektronen der Atome die elektromagnetische Energie aus der Lichtquelle absorbieren. Wenn das Licht auf Atome, Ionen oder Moleküle gerichtet ist. Das Spektrophotometer kann die Menge der absorbierten Wellenlänge aufzeichnen, und der Wissenschaftler kann dann auf die Liste der Elementmerkmale verweisen, um die Zusammensetzung der gesammelten Probe zu bestimmen.
Emissionsspektren werden mit dem gleichen Prozess der Lichtuntersuchung durchgeführt. In diesen Prozessen beobachtet der Wissenschaftler jedoch die Menge an Licht oder Wärmeenergie, die von den Photonen des Atoms emittiert wird, wodurch sie zu ihrem ursprünglichen Quantum zurückkehren lassen.
Stellen Sie sich das so vor: Die Sonne ist das Zentrum des Atoms, bestehend aus Photonen und Neutronen. Die Planeten, die die Sonne umkreisen, sind die Elektronen. Wenn eine riesige Taschenlampe auf die Erde gerichtet ist (als Elektron), wird die Erde aufgeregt und bewegt sich in die Umlaufbahn von Neptun. Die von der Erde absorbierte Energie wird in den Absorptionsspektren aufgezeichnet.
Wenn die riesige Taschenlampe entfernt wird, gibt die Erde Licht aus, damit sie in ihren ursprünglichen Zustand zurückkehrt. In solchen Fällen erfasst das Spektrophotometer die Menge der von der Erde emittierten Wellenlänge, damit der Wissenschaftler die Art der Elemente bestimmen kann, die aus dem Sonnensystem bestehen.
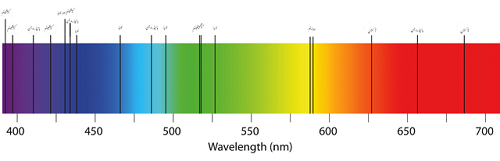
Absorptionsspektrum von wenigen Elementen
Darüber hinaus benötigt Absorption im Gegensatz zu Emissionsspektren nicht die Anregung der Ionen oder Atome, im Gegensatz zu Emissionsspektren. Beide müssen eine Lichtquelle haben, aber diese sollten in den beiden Prozessen variieren. Quarzlampen werden normalerweise in Absorption verwendet, während die Brenner für Emissionsspektren geeignet sind.
Ein weiterer Unterschied zwischen den beiden Spektren liegt in der Ausgabe „Print“. Bei der Entwicklung eines Bildes ist das Emissionsspektrum beispielsweise das farbige Foto, während das Absorptionsspektrum der negative Druck ist. Hier ist der Grund: Emissionsspektren können Licht ausgeben, das sich auf die verschiedenen Bereiche des elektromagnetischen Spektrums erstreckt, wodurch farbige Linien mit niedriger Energiewellen zu Gammastrahlen mit hoher Energie erzeugt werden. Farben im Prisma werden normalerweise in diesen Spektren beobachtet.
Auf der anderen Seite kann die Absorption mehrere Farben mit leeren Linien aussagen. Dies liegt daran, dass die Atome Licht in einer Frequenz absorbieren, die von der Art der in der Probe vorhanden. Es ist unwahrscheinlich, dass das wieder emittierte Licht in die gleiche Richtung emittiert wird. Da das Licht des Atoms nicht an den Wissenschaftler gerichtet werden kann, scheinen die Lichter aufgrund der fehlenden Wellen in den elektromagnetischen Spektren schwarze Linien zu haben.
Zusammenfassung:
1.Emissions- und Absorptionsspektren können beide zur Bestimmung der Zusammensetzung der Materie verwendet werden.
2.Beide verwenden eine Lichtquelle und ein Spektrophotometer.
3.Emissionsspektren messen die Wellenlänge des emittierten Lichts, nachdem die Atome mit Wärme angeregt wurden, während die Absorption die vom Atom absorbierte Wellenlänge misst.
4.Emissionsspektren emittieren alle Farben im elektromagnetischen Spektrum, während die Absorption aufgrund der Umleitung der Wiedereinstellung von absorbierten Photonen einige Farben fehlen kann.
- « Unterschied zwischen Brutto- und Feinmotorikfähigkeiten
- Unterschied zwischen Epidemiologie und Ätiologie »

