Unterschied zwischen kristallinem und amorphem Unterschied

- 1909
- 275
- Hugo Poehn
Amorph und kristallin sind zwei Zustände, die typische Feststoffe in der Chemie beschreiben. Unter Verwendung von Röntgenbeugungsexperimenten kann die Struktur von Festkörpern in kristalline oder amorph (nicht kristallines) kategorisiert werden.
Festkörper gehören zu den drei Grundzuständen der Materie, die Flüssigkeiten und Gase umfassen. Sie sind durch eine starre Struktur von Molekülen, Ionen und Atomen gekennzeichnet, die ordentlich oder nicht ordentlich angeordnet sind. Diese geordneten oder nicht ordnungsgemäßen Anordnungen haben zu der Kategorisierung als amorph und kristallin geführt, und dieser Artikel entfaltet die wichtigsten Unterschiede zwischen den beiden Begriffen.

Was ist kristallin?
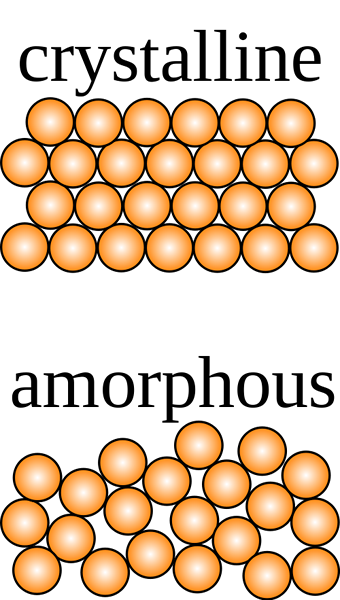
Ein kristalliner Feststoff ist das, in dem die Bestandteile in einem dreidimensionalen Muster ordnungsgemäß angeordnet sind.
Die innere Struktur hat eine ausgeprägte geometrische Form und zeigt eine klare Spaltung, wenn sie irgendwo in der Struktur geschnitten wird. Das dreidimensionale Muster, das unter Verwendung der Röntgenstrahlen beobachtet wird, wird verwendet, um den Feststoff zu identifizieren. Es ist jedoch nicht einfach, den Unterschied zwischen kristallinen und nichtkristallinen Feststoffen durch Berühren festzustellen. Sie unterscheiden sich in vielen Aspekten voneinander, einschließlich chemischer und physikalischer Eigenschaften.
Kristalline Feststoffe (Kristalle) benötigen extreme Temperaturen, um die intermolekularen Kräfte zu brechen. Sie haben eine bestimmte Hitze der Fusions- und Schmelzpunkte aufgrund der einheitlichen Anordnung ihrer Komponenten. Die lokale Umgebung ist auch einheitlich. Wenn sie jedoch in eine Richtung geschnitten werden, sind die physikalischen Eigenschaften unterschiedlich als anisotrop bekannt. Wenn die Struktur von Kristallen um die Achse um die Achse gedreht wird, bleibt dies gleich und wird als symmetrische Anordnung von Molekülen, Atomen oder Ionen bezeichnet.
Einige kristalline Feststoffe können je nach Kühlprozess amorph werden. Andere können ihre Komponenten aufgrund des Vorhandenseins von Verunreinigungen falsch ausrichten lassen. Außerdem können kühlende Substanzen schnell zu einer amorphen Struktur mit unregelmäßigen geometrischen Formen führen. Quarz zum Beispiel ist kristallin mit Silikon- und Sauerstoffatomen ordnungsgemäß. Aber wenn es schnell abgekühlt ist, kann es zum amorphen Strukturglas führen. Es kommt normal vor. Gummi, Polymer und Glas gehören zu den perfekten Beispielen für wichtige amorphe Festkörper.
Der Brechungsindex, die mechanische Festigkeit, die thermische Leitfähigkeit und die elektrische Leitfähigkeit kristalliner Feststoffe unterscheiden sich in verschiedene Richtungen. Das ist der Nachteil dieser Arten von Feststoffen im Vergleich zu nichtkristallinen Feststoffen. Die gute Seite eines anisotropen Feststoff. Es zeigt die wahren Eigenschaften eines Feststoffs mit großer Reihenfolge und einer starren Struktur.
Was ist amorph?
Das Wort amorph wird vom griechischen Wort amorph abgeleitet, was „formlos“ bedeutet. Dies ist die formlose, ungeordnete und unregelmäßige Anordnung der Bestandteile eines Feststoffs. Ihre intermolekularen Kräfte sind nicht gleich, noch sind die Entfernungen zwischen den Partikeln. Bei der Spaltung ergeben amorphe Feststoffe aufgrund unregelmäßiger geometrischer Formen Fragmente oder gekrümmte Oberflächen.
Einige amorphe Feststoffe können Teile ordentlicher angeordneter Muster haben, die als Kristallite bezeichnet werden. Die Atome, Ionen oder Moleküle des Feststoffs hängen vom Kühlprozess ab. Der Quarzkristall unterscheidet sich aufgrund des Kristallisationsprozesses mit Quarzglas. Im Allgemeinen haben viele amorphe Feststoffe ein ungeordnetes Muster. Sie werden normalerweise als supergekühlte Feststoffe bezeichnet, weil die Struktur einige Eigenschaften mit Flüssigkeiten teilt. Sie zeigen auch nicht die wahren Eigenschaften von Festkörpern, sondern werden dennoch vorwiegend in zahlreichen Anwendungen verwendet.
Wärmeleitfähigkeit, mechanische Festigkeit, elektrische Leitfähigkeit und Brechungsindex sind in allen Richtungen von amorphen Feststoffen gleich. Dies erklärt, woher der Name isotropisch kommt. Die Feststoffe haben keine scharfen Schmelzpunkte oder eine bestimmte Fusionswärme. Ein breiter Temperaturbereich muss angewendet werden, bevor sie schmelzen können. Darüber hinaus sind amorphe Feststoffe durch eine kurze Reichweite gekennzeichnet. Beispiele für amorphe Feststoffe sind Polymere, Gummi, Kunststoffe und Glas.
Wenn ein amorpher Feststoff noch lange unter seinem Schmelzpunkt übrig bleibt, kann er sich in einen kristallinen Feststoff verwandeln. Es kann die gleichen Eigenschaften darstellen, die die kristallinen Festkörper besitzen.
Schlüsselunterschiede zwischen Amorph und Kristallin
Struktur von Kristallin und Amorph
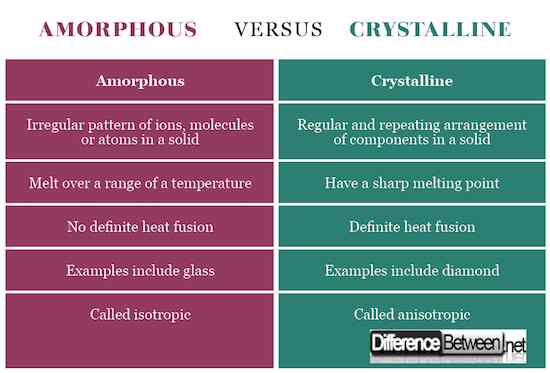
Kristalline Feststoffe haben eine bestimmte Form mit geordneten Ionen, Molekülen oder Atomen in einem dreidimensionalen Muster, das häufig als Kristallgitter bezeichnet wird. Wenn sie geschnitten sind, zeigen sie eine klare Spaltung mit Oberflächen, die sich in Winkeln schneiden, die für den Kristall charakteristisch sind. Amorphe Feststoffe hingegen haben eine ungeordnete Reihe von Komponenten, die keine bestimmte Form zeigen. Wenn sie geschnitten sind, zeigen sie unregelmäßige Formen normalerweise mit gekrümmten Oberflächen. Kristalline Komponenten werden durch gleichmäßige intermolekulare Kräfte zusammengehalten, während bei amorphen Feststoffen sich diese Kräfte von einem Atom zum anderen unterscheiden.
Schmelzpunkte von kristallinen und amorphen Punkten
Amorphe Feststoffe haben keine bestimmten Schmelzpunkte, sondern schmelzen aufgrund der unregelmäßigen Form über einen weiten Temperaturbereich. Kristalline Feststoffe hingegen haben einen scharfen Schmelzpunkt.
Physikalische Eigenschaften kristalline und amorphes Eigenschaften
Kristalline Feststoffe besitzen unterschiedliche elektrische Leitfähigkeit, thermische Leitfähigkeit, Brechungsindex und mechanische Stärke innerhalb eines Kristalls in unterschiedliche Richtungen, daher werden sie als Anisotrop bezeichnet. Amorph werden aufgrund ähnlicher physikalischer Eigenschaften in beiden Richtungen isotrop bezeichnet.
Beispiele für kristallin und amorph
Beispiele für einen kristallinen Feststoff umfassen NaCl, Zucker und Diamant, während die Beispiele für amorphe Feststoffe Glas, Gummi und Polymere umfassen.
Siehe das Vergleichstabelle für kristalline Verse amorph unten:
Zusammenfassung kristalline Verse amorph
- Kristalline Feststoffe haben ein regelmäßiges dreidimensioniertes Muster von Ionen, Atomen oder Molekülen, während amorphe Feststoffe eine zufällige Anordnung dieser Komponenten aufweisen
- Kristalline Feststoffe haben einen genauen Schmelzpunkt, während amorphe Feststoffe über einen Temperaturbereich schmelzen
- Amorphe Feststoffe ergeben beim Spalten Fragmente mit unregelmäßigen Mustern, während kristalline Feststoffe eine bestimmte Form darstellen
- Kristalline bezeichnet aufgrund verschiedener physikalischer Eigenschaften in alle Richtungen, während amorph als isotrop bezeichnet wird
- Beispiele für amorph sind Glas und die von Kristallin umfassen Diamond.

