Butan vs. Methan

- 2330
- 484
- Ines Plank
Butan Und Methan sind Kohlenwasserstoffe aus den gleichen Verbindungen der chemischen Familie, die als Alkane bekannt sind. Sie sind Bestandteile des Erdgass und der Extraktion von Öl.
Vergleichstabelle
Unterschiede - Ähnlichkeiten -| Butan | Methan | |
|---|---|---|
| CAS-Nummer | 106-97-8 y | 74-82-8 y |
| Pubchem | 7843 | 297 |
| Chemspider | 7555 | 291 |
| Lächeln | CCCC | C |
| Inchi | 1/C4H10/C1-3-4-2/H3-4H2,1-2H3 | 1/CH4/H1H4 |
| Molekularformel | C4H10 | CH4 |
| Molmasse | 58.12 g mol - 1 | 16.042 g/mol |
| Aussehen | Farbloses Gas | Farbloses Gas |
| Dichte | 2.48 kg/m3, Gas (15 ° C, 1 atm) 600 kg/m3, Flüssigkeit (0 ° C, 1 atm) | 0.717 kg/m3, Gas 415 kg/m3 Flüssigkeit |
| Schmelzpunkt | –138.4 ° C (135.4 k) | -182.5 ° C, 91 K, -297 ° F |
| Siedepunkt | –0.5 ° C (272.6 k) | -161.6 ° C, 112 K, -259 ° F |
| Löslichkeit in Wasser | 6.1 mg/100 ml (20 ° C) | 45 mg/l (17 ° C) |
| MSDs | Externe MSDs | Externe MSDs |
| NFPA 704 | 4 1 0 | 4 1 0 |
| Flammpunkt | –60 ° C | -188 ° C |
| Sprenggrenzen | 1.8 - 8.4% | 5 - 15% |
| Verwandte Alkane | Propan; Pentan | Ethane, Propan |
| Verwandte Verbindungen | Isobutan; Cyclobutan | Methanol, Chlormethan, Ameisensäure, Formaldehyd, Silan |
| Struktur und Eigenschaften | N, εr usw. | N, εr usw. |
| Thermodynamische Daten | Phasenverhalten fest, flüssig, gas | Phasenverhalten fest, flüssig, gas |
| Spektraldaten | UV, Ir, NMR, MS | UV, Ir, NMR, MS |
| Verwendet | Butan wird in Kühlung, Zigaretten -Feuerzeugen, Erhitzen als LPG oder verflüssigtem Erdölgas verwendet. | Methan ist eine Energiequelle, die für Heizzwecke verwendet wird. |
| Schädliche Auswirkungen | Butan kann Erstickung und ventrikuläre Fibrillation verursachen. | Methan ist ein starkes Treibhausgas. Es kann explosive Gemische mit Luft bilden. |
| Quellen | Rohöl, Erdgas. | Erdgasfelder, Biogasproduktion, atmosphärisches Methan, zusätzliches terrestrisches Methan. |
Chemische Formel und molekulare Struktur von Methan gegen Butan
Butan ist c4H10 Während Methan die chemische Formel hat - ch4. Somit gibt es vier Wasserstoffatome in einem Methanmolekül, während zehn Wasserstoffatome in einem Butanmolekül zehn Wasserstoffatome. Das Methanmolekül bildet eine tetraedrische Struktur, während Butan eine lineare Struktur ist.
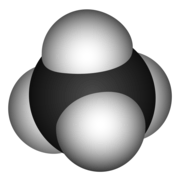 Methanmolekül - 3D -Rendering
Methanmolekül - 3D -Rendering 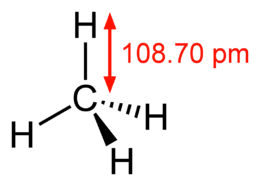 Methanmolekül - Strukturformel, bestimmt unter Verwendung von Mikrowellenspektroskopie
Methanmolekül - Strukturformel, bestimmt unter Verwendung von Mikrowellenspektroskopie 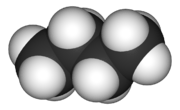 Butanmolekül - 3 -dimensionales Rendering
Butanmolekül - 3 -dimensionales Rendering 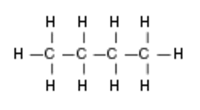 Butanmolekül - Chemische Formel
Butanmolekül - Chemische Formel Chemische Reaktionen von Methan und Butan
Butan reagiert mit Sauerstoff, um Kohlendioxid und Wasserdampf zu bilden. Unter Bedingungen begrenzter Sauerstoff kann Butan Kohlenmonoxid oder verkohltes Kohlenstoff bilden. Es reagiert mit Chlor, um Chlorobutane und andere Derivate zu verleihen. Methan Verbrannt. Der Prozess wird als Pyrolyse bezeichnet.
Leichter im Umgang
Sowohl Methan als auch Butan sind geruchlose Gase bei Raumtemperaturen. Butan kann leicht verflüssigen. Es wird mit Propan und anderen Kohlenwasserstoffen von LPG gemischt, die kommerziell zum Erhitzen und Kochen verwendet werden. Methan ist schwer zu transportieren und wird durch Pipelines und LNG -Fluggesellschaften transportiert.
Im Gegensatz zu Methan, das ein hartnäckiges Gas bei normalem Druck und Temperatur ist, verwandelt sich Butan beim Komprimieren in eine Flüssigkeit. Diese Eigenschaft wird auf die schwachen zentralen Kohlenstoffatombindungen zurückgeführt. Sobald dieses verflüssige Gas mit Luft in Kontakt kommt, reagiert es mit Zündquelle und wird entzündlich.
Isomere
Butan weist im Gegensatz zu Methan strukturelle Isomerismus auf und hat zwei Isomere, N-Butane und ISO-Butane. Methan zeigt keinen Isomerismus.
Verwendung von Methan gegen Butan
Butan wird in Deodorants, Zigaretten -Feuerzeugen, Koch- und Heizzylindern, Treibmittel in Aerosolsprays und Kältemitteln usw. verwendet. Methan, das auch als Sumpf- oder Sumpfgas bekannt ist.
Quellen
Methan ist in Feuchtgebieten und Ozeanen, Atmosphäre, menschliche Quellen wie Brennen von Kraft. Butan kann als Nebenprodukt während der Extraktion von Rohöl erhalten werden und ist ein Bestandteil von Erdgas.

