Homogener vs. Heterogene Gemische

- 3602
- 780
- Fr. Fine Zschunke
Gemische unterscheiden sich von reinen Substanzen wie Elementen und Verbindungen, da Gemische unterschiedliche Substanzen enthalten. Die einzelnen Komponenten in einer Mischung behalten ihre Identität bei.
Gemische sind zwei Arten: homogen und heterogen. Eine homogene Mischung hat eine einheitliche Zusammensetzung und ein gleichmäßiges Aussehen. Einzelne Substanzen, die eine homogene Mischung ausmachen. Andererseits umfasst eine heterogene Mischung zwei oder mehr Substanzen, die deutlich beobachtet und sogar relativ leicht getrennt werden können.
Vergleichstabelle
Unterschiede - Ähnlichkeiten -| Heterogen | Homogen | |
|---|---|---|
| Uniform | NEIN | Ja |
| Sie können die Teile sehen | Ja | NEIN |
| Kann physisch getrennt werden | Ja | NEIN |
| Beispiele | Salat, Trailmischung | Olivenöl, Stahl, Salz in Wasser |
| Chemisch gebunden | NEIN | NEIN |
Physikalische Eigenschaften
Alle Gemische umfassen zwei oder mehr reine Substanzen (Elemente oder Verbindungen). Der Unterschied zwischen einer Mischung und einer Verbindung besteht darin. Verbindungen sind reine Substanzen, da sie nur eine Art von Molekül enthalten. Moleküle bestehen aus Atomen, die sich miteinander verbunden haben. Aber in einer Mischung werden Elemente und Verbindungen vermischt gefunden physisch aber nicht chemisch-Es bilden sich keine atomaren Bindungen zwischen den reinen Substanzen, die die Mischung bilden.
Unabhängig von Atombindungen können Gemische ziemlich kohärent werden. Allgemein genannt Lösungen, Homogene Gemische sind solche, bei denen sich die Substanzen so gut mischen, dass sie nicht einzeln in einer differenzierten, unterschiedlichen Form gesehen werden können. Ihre Komposition ist einheitlich i.e., Gleiches gilt während der gesamten Mischung. Diese Gleichmäßigkeit liegt daran, dass die Bestandteile einer homogenen Mischung in jedem Teil der Mischung in gleichem Verhältnis auftreten.
Umgekehrt ist eine heterogene Mischung eine, bei der die Bestandteile nicht gleichmäßig verteilt sind. Sie können oft visuell getrennt und sogar relativ leicht getrennt werden, obwohl es viele Methoden gibt, um auch homogene Lösungen zu trennen.
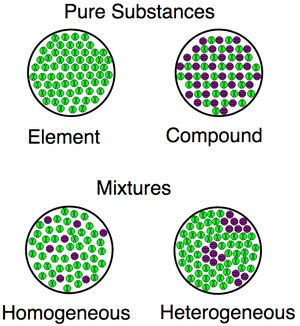 Eine Visualisierung der Unterschiede zwischen Substanzen (Verbindungen, Elemente) und Gemischen (sowohl homogen und heterogen).
Eine Visualisierung der Unterschiede zwischen Substanzen (Verbindungen, Elemente) und Gemischen (sowohl homogen und heterogen). Beispiele für homogene und heterogene Gemische
Beispiele für heterogene Gemische wären Eiswürfel (bevor sie schmelzen) in Soda, Getreide in Milch, verschiedene Beläge auf einer Pizza, Beläge im gefrorenen Joghurt, einer Schachtel mit verschiedenen Nüssen. Sogar eine Mischung aus Öl und Wasser ist heterogen, da die Dichte von Wasser und Öl unterschiedlich ist, was eine gleichmäßige Verteilung in der Mischung verhindert.
Beispiele für homogene Gemische sind Milchshakes, gemischtes Gemüsesaft, in Kaffee gelöste Zucker, Alkohol in Wasser und Legierungen wie Stahl. Sogar die Luft, die in unserer Atmosphäre liegt. Viele Substanzen wie Salz und Zucker lösen in Wasser, um homogene Gemische zu bilden.
Arten von Gemischen
Es gibt drei Mischfamilien: Lösungen, Suspensionen und Kolloiden. Lösungen sind homogen, während Suspensionen und Kolloide heterogen sind.
Lösung
Lösungen sind homogene Gemische, die einen in einem Lösungsmittel gelösten gelösten gelösten gelösten gelösten gelösten, e.G. Salz in Wasser gelöst. Wenn das Lösungsmittel Wasser ist, wird es als wässrige Lösung bezeichnet. Das Verhältnis der Masse des gelösten Stoffs zum Lösungsmittel wird als Konzentration der Lösung bezeichnet.
Lösungen können flüssig, gasförmig oder sogar fest sein. Nicht nur das, die einzelnen Komponenten der Lösung können unterschiedliche Materiezustände sein. Der gelöste gelöste nimmt die Phase (fest, flüssig oder gasförmig) des Lösungsmittels an, wenn das Lösungsmittel der größere Anteil der Mischung ist.
- Gasförmige Lösungen: Wenn das Lösungsmittel ein Gas ist, ist es nur möglich, gasförmige gelöste Stoffe darin aufzulösen. Das häufigste Beispiel für eine gasförmige Lösung ist die Luft in unserer Atmosphäre, die Stickstoff (das Lösungsmittel) ist und gelöste Stoffe wie Sauerstoff und andere Gase aufweist.
- Flüssige Lösungen: Flüssige Lösungsmittel können jegliche Art von Stoffen auflösen.
- Gas in Flüssigkeit: Beispiele sind Sauerstoff in Wasser oder Kohlendioxid in Wasser.
- Flüssigkeit in Flüssigkeit: Beispiel umfassen alkoholische Getränke; Sie sind Ethanollösungen im Wasser.
- Feste Flüssigkeit: Zucker- oder Salzlösungen in Wasser sind Beispiele für solche Gemische. Viele feste in flüssigen Gemischen sind nicht homogen, so dass sie keine Lösungen sind. Sie könnten Kolloiden oder Suspensionen sein.
- Feste Lösungen: Feste Lösungsmittel können auch gelöste Stoffe eines jeden Materiezustands auflösen.
- Gas in Feststoff: Ein Beispiel hierfür ist Wasserstoff in Palladium gelöst
- Flüssigkeit bei festem: Beispiele hier
- Feste Feste: Legierungen wie Stahl, Messing oder Bronze sind ein Beispiel für solche Gemische.
Suspension
Eine Suspension ist eine heterogene Mischung, die feste Partikel enthält, die groß genug für Sedimentation sind. Die festen Partikel lösen sich nicht im Lösungsmittel auf, sondern werden suspendiert und schwimmen frei. Sie sind größer als 1 Mikrometer und normalerweise groß genug, um für das bloße Auge sichtbar zu sein. Ein Beispiel ist Sand in Wasser. Ein wesentliches Merkmal von Suspensionen ist, dass sich die suspendierten Partikel im Laufe der Zeit absetzen, wenn sie ungestört bleiben.
Kolloid
Kolloide sind heterogen wie Suspensionen, scheinen jedoch visuell homogen zu sein, da die Partikel in der Mischung sehr klein-1-Nanometer bis 1 Mikrometer sind. Der Unterschied zwischen Kolloiden und Suspensionen besteht darin, dass die Partikel in Kolloiden kleiner sind und sich die Partikel nicht im Laufe der Zeit absetzen werden.
| Lösung | Kolloid | Suspension | |
|---|---|---|---|
| Homogenität | Homogen | Heterogen auf mikroskopischer Ebene, aber visuell homogen | Heterogen |
| Partikelgröße | < 1 nanometer (nm) | 1 nm - 1 Mikrometer (μm) | > 1 μm |
| Physisch stabil | Ja | Ja | Braucht stabilisierende Agenten |
| Zeigt Tyndall -Effekt | NEIN | Ja | Ja |
| Trennt durch Zentrifuge | NEIN | Ja | Ja |
| Trennt durch Dekantation | NEIN | NEIN | Ja |
Technik
Bis zu einem gewissen Grad könnten Sie sagen (wenn Sie pedantisch sind), dass die Frage, ob eine Mischung homogen oder heterogen ist.
Wenn die Stichprobenkala in Ordnung ist (klein), kann es so klein sein wie ein einzelnes Molekül. In diesem Fall würde jede Stichprobe heterogen werden, da sie in dieser Größenordnung deutlich abgegrenzt werden kann. Wenn die Probe die gesamte Mischung ist, können Sie es in ähnlicher Weise als homogen genug betrachten.
Um praktisch zu bleiben, verwenden wir diese Faustregel, um zu entscheiden, ob eine Mischung homogen ist: Wenn die von der Mischung interessierende Eigenschaft der Mischung gleich ist, unabhängig davon, welche Probe für die verwendete Untersuchung durchgeführt wird, ist die Mischung homogen.

