Unterschied zwischen Phosphor und Phosphat
- 2369
- 543
- Cem Schlitzer
Was ist Phosphor?
Phosphor (P) ist ein multivalentes nichtmetales chemisches Element der VA-Gruppe, Nr. 15 des periodischen Systems. Seine Molmasse beträgt 30.97. 23 Isotope von Phosphor sind bekannt, aber nur einer von ihnen ist stabil.

Phosphor ist ein hochreaktives Element. Es reagiert mit Sauerstoff, Halogenen, Schwefel und vielen Metallen. Aufgrund seiner hohen Reaktivität kann Phosphor nicht als freies Element auf der Erde gefunden werden.
Das Phosphoratom enthält fünf Valenzelektronen auf seiner Außenschicht. In Verbindungen mit Metallen und Wasserstoff weist Phosphor einen Oxidationsgrad von -3 und in Wechselwirkung mit elektronegativeren Elementen wie Sauerstoff, Fluor usw. auf., Die Oxidationsgrade betragen +3 oder +5.
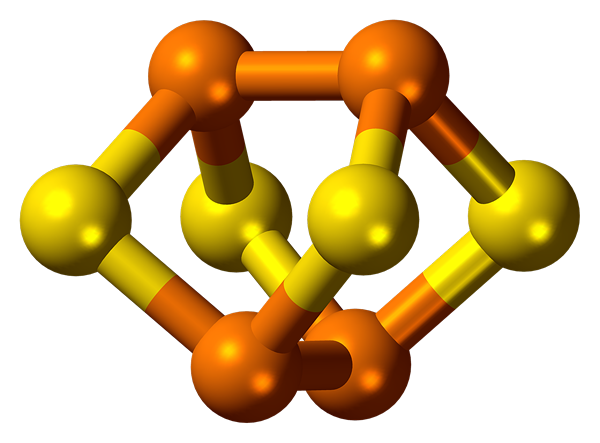
Phosphor ist durch Allotropie gekennzeichnet. Es bildet mehrere einfache Substanzen, die sich in Struktur und Eigenschaften unterscheiden. Die am weitesten verbreitetsten sind weiß und roter Phosphor.
Der weiße Phosphor besteht aus p4 Moleküle. Es ist eine weiße wachsartige Substanz mit einer gelben Tönung, die im Dunkeln leuchtet. Der weiße Phosphor ist in Wasser nicht löslich, sondern in Kohlenstoffdisulfid löslich. Es ist giftig. Es ist hochreaktiv und kann spontan entzünden.
Der rote Phosphor hat ein Kristallatomgitter. Es löst sich nicht in Wasser und Kohlenstoffdisulfid auf. Es ist nicht giftig und hat eine geringere Aktivität im Vergleich zum weißen Phosphor.
Die allotropen Modifikationen von Phosphor sind miteinander umgänglich.
Was ist Phosphat?
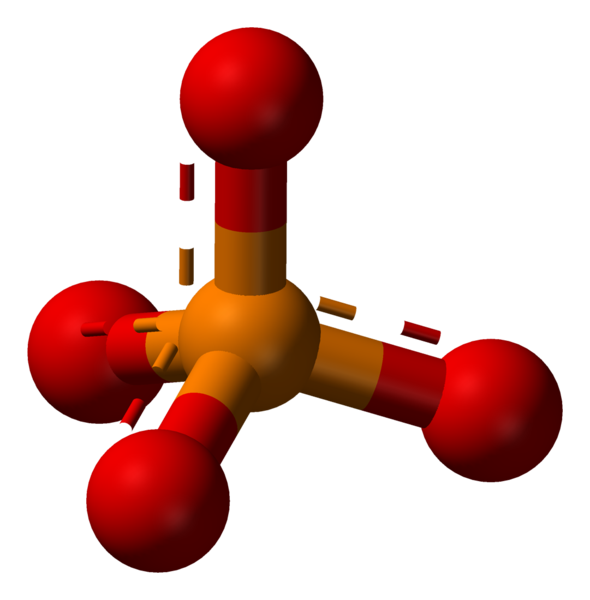
Phosphat ist ein chemisches Derivat der Phosphorsäure, das das Phosphation (PO) enthält3-4). Das Phosphation kann eine Vielzahl verschiedener Salze bilden. Formal ist jedes Salz eines Phosphoroxoacids ein Phosphat.
Das Phosphation ist ein polyatomisches Ion mit einer tetraedrischen Anordnung der Atome. Es besteht aus einem Phosphor -Atom, das sich in der Mitte befindet und von vier Sauerstoffatomen umgeben ist. Die Molmasse des Phosphation ist 94.97 g/mol.
Abhängig von der Anzahl der Phosphoratome können Phosphate in vier Hauptgruppen unterteilt werden: Orthophosphate, Pyrophosphate, Tripolyphosphate und Polyphosphate. Jede dieser Gruppen hat ihre eigenen spezifischen funktionalen Eigenschaften.
Unterschied zwischen Phosphor und Phosphat
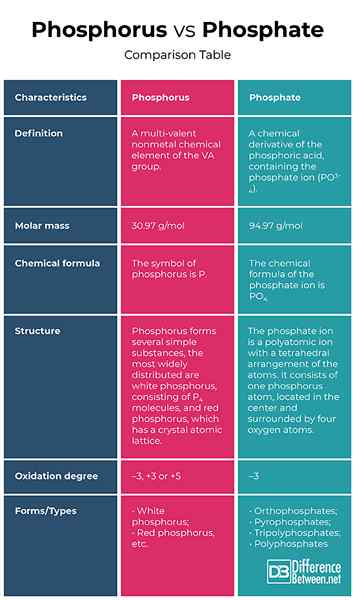
Definition
Phosphor: Phosphor ist ein multivalentes nichtmetales chemisches Element der VA-Gruppe.
Phosphat: Phosphat ist ein chemisches Derivat der Phosphorsäure, das das Phosphation (PO) enthält3-4). Formal ist jedes Salz eines Phosphoroxoacids ein Phosphat.
Molmasse
Phosphor: Die Molmasse des Phosphors beträgt 30.97 g/mol.
Phosphat: Die Molmasse des Phosphation ist 94.97 g/mol.
Chemische Formel
Phosphor: Das Symbol des Phosphors ist p.
Phosphat: Die chemische Formel des Phosphation ist PO4.
Struktur
Phosphor: Phosphor bildet mehrere einfache Substanzen, die am weitesten verbreiteten weißen Phosphor, bestehend aus p4 Moleküle und rotes Phosphor, das ein Kristallatomgitter aufweist.
Phosphat: Das Phosphation ist ein polyatomisches Ion mit einer tetraedrischen Anordnung der Atome. Es besteht aus einem Phosphor -Atom, das sich in der Mitte befindet und von vier Sauerstoffatomen umgeben ist.
Oxidationsgrad
Phosphor: In Verbindungen mit Metallen und Wasserstoff weist Phosphor einen Oxidationsgrad von -3 und in Wechselwirkung mit elektronegativeren Elementen wie Sauerstoff, Fluor usw. auf., Der Oxidationsgrad beträgt +3 oder +5.
Phosphat: Phosphat zeigt einen Oxidationsgrad von -3.
Formulare/Typen
Phosphor: Phosphor ist durch Allotropie gekennzeichnet und bildet mehrere einfache Substanzen, die sich in Struktur und Eigenschaften unterscheiden. Die am weitesten verbreitetsten sind weiß und roter Phosphor.
Phosphat: Abhängig von der Anzahl der Phosphoratome, Phosphate sind Orthophosphate, Pyrophosphate, Tripolyphosphate und Polyphosphate.
Phosphor vs. Phosphat: Vergleichstabelle
Zusammenfassung von Phosphor vs. Phosphat:
- Phosphor ist ein multivalentes nichtmetales chemisches Element der VA-Gruppe.
- Phosphat ist ein chemisches Derivat der Phosphorsäure, das das Phosphation (PO) enthält3-4). Formal ist jedes Salz eines Phosphoroxoacids ein Phosphat.
- Die Molmasse des Phosphors beträgt 30.97 g/mol. Die Molmasse des Phosphation ist 94.97 g/mol.
- Das Symbol des Phosphors ist p. Die chemische Formel des Phosphation ist PO4.
- Der weiße Phosphor besteht aus p4 Moleküle, der rote Phosphor hat ein Kristallatomgitter. Das Phosphation ist ein polyatomisches Ion mit einer tetraedrischen Anordnung der Atome, die aus einem Phosphoratom besteht, das sich in der Mitte befindet und von vier Sauerstoffatomen umgeben ist.
- Phosphor zeigt einen Oxidationsgrad von -3, +3 oder +5. Phosphat zeigt einen Oxidationsgrad von -3.
- Phosphor bildet mehrere einfache Substanzen, die sich in Struktur und Eigenschaften unterscheiden. Die am weitesten verbreiteten weißen und roten Phosphor sind am weitesten verbreitet. Abhängig von der Anzahl der Phosphoratome, Phosphate sind Orthophosphate, Pyrophosphate, Tripolyphosphate und Polyphosphate.

