Unterschied zwischen Molarität und Molalität
- 3239
- 359
- Prof. Dr. Charleen Lammert
Was ist Molarität?
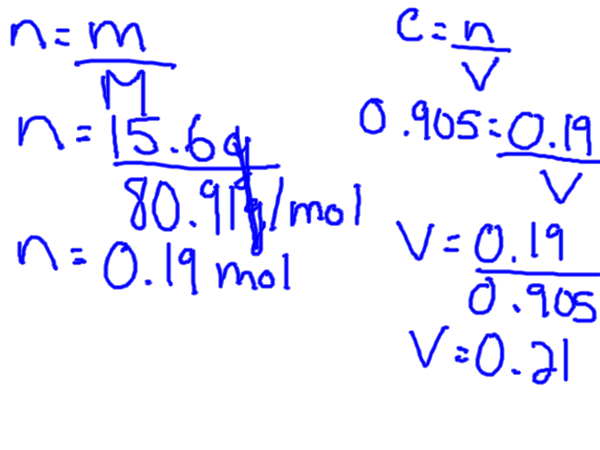
Molarität kann als die Anzahl der Mol eines Substanz (bekannt als der gelöste Stoff) definiert werden, der in genau 1 Liter einer Lösung gelöst ist (Lösungsmittel und gelöste Stoff kombiniert).
Die Formel zur Berechnung der Molarität ist daher wie folgt:
M = Maulwurf gelöscht / l Lösung
Molarität wird auch allgemein als Molkolonik bezeichnet. Daher ein Maß für die molare Konzentration basierend auf dem Flüssigkeitsvolumen, in dem eine Substanz gelöst ist. Es ist wichtig zu erkennen, dass sich das Volumen in Litern befindet, sodass Sie möglicherweise zuerst konvertieren müssen, wenn Sie beispielsweise Volumen in ML haben.
Um eine molare Konzentration vorzubereiten.

Zum Beispiel: Man kann eine bestimmte molare Zuckerkonzentration ausmachen. Das Gewicht des Zuckers muss zuerst in Maulwürfe umgewandelt werden und dann wird das Wasser zugesetzt, bis 1 Liter erreicht ist.
Um die Molarität zu berechnen, benötigen Sie den gelösten Stoff in Maulwürfen, aber normalerweise haben Sie ein bestimmtes Gewicht des gelösten Stoffes, was bedeutet, dass Sie zuerst die Gramm in Maulwürfe umwandeln müssen. Dies kann durch die Finden der Molmasse des gelösten Stoffes aus der Periodenkabine erfolgen.
Die molare Konzentrationsformel kann neu angeordnet werden, um sowohl für Volumen als auch für Maulwürfe zu lösen.
Das Volumen wird durch Änderungen der Temperatur oder des Drucks beeinflusst. Zum Beispiel würde das Volumen mit zunehmender Temperatur zunehmen. Dies bedeutet, dass es eine Frage der Genauigkeit gibt, bei der sich die Temperaturänderungen ändern.
Wenn die Temperatur ausreichend abnimmt, kann sich die Flüssigkeit zusammenziehen, was dazu führt.
Umgekehrt kann sich die Flüssigkeit ausdehnen, wenn die Temperatur ausreicht, was dazu führt, dass sich die Molarität abnimmt, da die gleiche Anzahl von Mol verbleibt.
Molarität kann verwendet werden.
Molarität kann verwendet werden, wenn eine genaue Präzision nicht erforderlich ist. Es wird jedoch durch Temperaturänderungen beeinflusst, da es sich um eine volumetrische Messung handelt. In einigen Fällen ist es möglicherweise nicht angemessen zu verwenden.
Molarität und Molalität können in einigen Fällen gleich sein. Zum Beispiel wiegt 1 Liter Wasser 1 kg.
Was ist Molalität?
Molalität kann als die Anzahl der Substanzmolen (bekannt als Stoff) definiert werden.
Die Formel zur Berechnung der Molalität Ist :
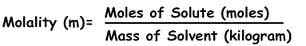
M = Maulwurf gelöscht / kg Lösungsmittel
Molalität wird auch als Molalkonzentration bezeichnet.
Ein Beispiel für eine Molalkonzentration wäre, beispielsweise eine bestimmte Menge Zucker zu gewichten. Dies muss dann unter Verwendung der molekularen Masse des Zuckers in die Anzahl der Mol umgewandelt werden. Dann wird ein Becherwasser gewogen und dem Becherglas Wasser hinzugefügt, bis es 1 kg wiegt.
Der Zucker wird dann zum Wasserbecher zugesetzt und aufgelöst.
Der Vorteil der Molalität gegenüber Molarität besteht darin, dass sie von Temperatur- und Druckänderungen nicht beeinflusst wird, da sie basierend auf der Masse und nicht auf Volumen berechnet wird. Die Masse des Lösungsmittels wird nicht von der Temperatur so beeinflusst, wie das Volumen einer Substanz ist, daher ist Molalität ein genaueres Maß für die Konzentration als die Molarität.
Bei Wasser kann die Molarität und Molalität gleich sein, da 1 Liter Wasser 1 kg wiegt. Dies ist jedoch möglicherweise bei allen Flüssigkeiten nicht der Fall.
Dies bedeutet, dass die Molalität verwendet werden muss, wenn sich kolligative Eigenschaften befassen.
Die Molalität ist genauer und bietet eine stärkere Konzentrationsgenauigkeit, dauert jedoch länger, da der gelöste Stoff zum Gewicht eines Lösungsmittels hinzugefügt werden muss. Wenn das Lösungsmittel flüssig ist, muss dies gewogen werden.
Dies kann mit einem gravimetrischen System und einem analytischen Gleichgewicht erfolgen, um das Lösungsmittel abzuwägen.
Was ist der Unterschied zwischen Molarität und Molalität?
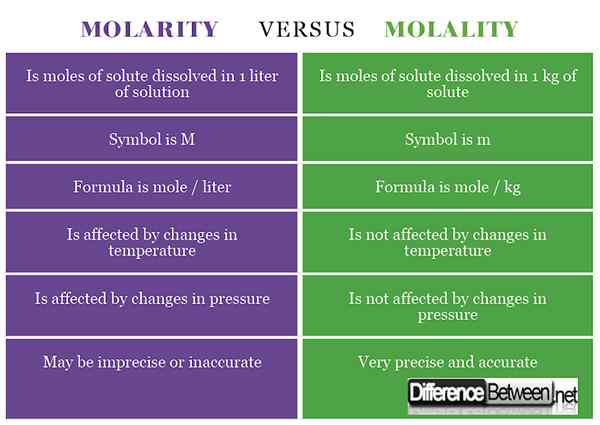
1) Molarität ist die Konzentration eines Substanz.
2) Das Symbol für Molarität ist m, während das für Molalität M ist (manchmal als -m oder geschrieben oder M es von der Masse zu unterscheiden).
3) Die Formel für Molarität lautet Mol / Liter, während die Formel für Molalität Maulwürfe / kg ist.
4) Die Molarität wird durch Temperaturänderungen beeinflusst, während die Molalität von Temperaturänderungen nicht beeinflusst wird.
5) Molarität wird durch Druckänderungen beeinflusst, während die Molalität durch Druckänderungen nicht beeinflusst wird.
6) Molarität kann zu einer ungenauen und ungenauen Konzentration führen, während die Molalität zu einer genauen präzisen Messung der Konzentration führt.
Tabelle zum Vergleich von Molarität und Molalität
Zusammenfassung von Molarität und Molalität
- Sowohl Molarität als auch Molalität können sowohl zur Messung der Konzentration verwendet werden.
- Molarität ist definiert als die Anzahl der Mol eines gelösten Stoffes, die in 1 Liter einer Lösung gelöst sind.
- Molalität ist definiert als die Anzahl der Mol eines gelösten Stoffes, die in 1 kg Lösungsmittel gelöst sind.
- Molalität ist ein präziseres und genaueres Mittel, um eine bestimmte Konzentration vorzunehmen, da sie von Temperatur- und Druckänderungen nicht beeinflusst wird.
- Molarität beinhaltet eine Flüssigkeit, was bedeutet, dass sich die Konzentration ändern kann. Dies liegt daran, dass sich das Volumen, das eine Flüssigkeit ist.
- « Unterschied zwischen geistiger Behinderung und Entwicklungsbehinderung
- Unterschied zwischen Groupby und Orderby »

