Unterschied zwischen globulärem Protein und faserigen Proteinen
- 5073
- 1034
- Rahel Diedrich

Globuläres Protein gegen Faserproteine
Proteine sind die chemischen Nährstoffe, die für den Bau verschiedener Gewebe des Körpers sowie für die Reparatur abgenutzter Zellen benötigt werden. Proteine werden in 3 Hauptgruppen eingeteilt, nämlich globuläre Proteine, fibröse Proteine und Membranproteine.
Strukturunterschied
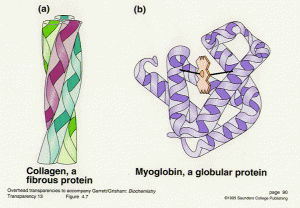
Ein kugelförmiges Protein hat eine sphärische Form und hat die Eigenschaft, Kolloide mit Wasser zu bilden. Es wird in Wasser aufgelöst. Globuläre Proteine werden aufgrund ihrer Form auch als Sphäroproteine bezeichnet. Faserproteine werden auch als Skleroproteine bezeichnet. Faserproteine sind längliche strangähnliche Strukturen und sind normalerweise in Form von Stäben oder Drähten vorhanden. Hämoglobin ist ein Beispiel für globuläres Protein, während Keratin, Kollagen und Elastin alle faserigen Proteine sind. Keratin ist in Haaren, Hörnern, Nägeln, Federn usw. vorhanden.
Ein wichtiges Unterscheidungsmerkmal ist, dass fibröse Proteine in Wasser, schwachen Säuren und schwachen Basen unlöslich sind, aber löslich in starken Säuren und Alkalien, während kugelförmige Proteine in Wasser, Säuren und Basen löslich sind. Die Peptidketten sind durch starke intermolekulare Wasserstoffbrückenbindungen in fibrösen Proteinen zusammengefasst, während sie in kugelförmigen Proteinen durch schwache intermolekulare Wasserstoffbrückenbindungen zusammengehalten werden. Skleroproteine Denaturieren nicht so leicht wie globuläre Proteine.
Faserproteine haben primäre und sekundäre Strukturen. Sie bestehen aus einer einzelnen Einheit oder Struktur, die mehrmals wiederholt wird. Faserproteine sind sehr resistent gegen die Verdauung durch Enzyme und extrem Zug. Globuläre Proteine bestehen nicht nur aus primären, sekundären, sondern auch tertiären und gelegentlich quaternären Strukturen. Globuläre Proteine bestehen aus geraden Ketten von Sekundärstrukturen, die sich abrupt Polypeptidketten verbinden und Richtungen ändern.
Unterschied in den Funktionen
Globuläre Proteine haben mehrere Funktionen, da sie zur Bildung von Enzymen, zellulären Boten, Aminosäuren verwendet werden, aber fibröse Proteine nur als Strukturproteine wirken. Globuläre Proteine sind stark verzweigte oder gewickelte Strukturen und sind hauptsächlich für den Transport von lebenswichtigen Nährstoffen wie Sauerstoff durch Hämoglobin verantwortlich. Globuläre Proteine sind die Hauptquelle für Hämoglobin, Immunglobine, Insulin und Milch-Protein-Kasein. Sie sind auch an der Bildung von Aminosäuren beteiligt, die grundlegende Bausteine aller Proteine sind. Sie werden für die Bildung chemischer Boten wie Hormone im Körper benötigt. Sie sind wesentlich für die Bildung von Transportern anderer Partikel durch die Membran. Myoglobin ist ein weiteres Beispiel für globuläres Protein, nämlich das Hauptprotein in den Muskeln.
Für die Bildung harter Strukturen wie Bindegewebe, Sehnen und Fasern des Muskels werden faserige Proteine benötigt. Kollagen ist ein Hauptbestandteil aller unserer Bindegewebe. Fibroin ist ein fibröses Protein. Faserproteine sind für die Herstellung der Bewegungen der Muskeln und Sehnen in einem Gelenk verantwortlich.
Zusammenfassung:
Faserige Proteine und globuläre Proteine unterscheiden sich in Größe, Form, Löslichkeit, Aussehen sowie in der Funktion. Faserproteine bestehen aus einer Wiederholung einer einzelnen Einheit, um Ketten zu bilden, die als Bindegewebe wirken und Stärke und Gelenkmobilität verleihen. Globuläre Proteine haben kugelförmige Form und bestehen aus langen Ketten mit zahlreichen Zweigen und Ableger, die sie als Transportproteine großartig machen. Beispiele für faserige Proteine sind Kollagen, Elastin, Keratin, Seide usw. Beispiele für kugelförmiges Protein sind Myoglobin, Hämoglobin, Kasein, Insulin usw.
- « Unterschied zwischen Urin und Blutschwangerschaftstests
- Unterschied zwischen Glaukom und Katarakt »

