Unterschied zwischen Endpunkt und Äquivalenzpunkt
- 1859
- 156
- Tina Gürbig
Endpunkt- und Äquivalenzpunkt sind die beiden wichtigsten Konzepte in Chemie -Titrationen. Die Technik von Titrationen kann bei Redoxreaktionen, Säure-Base-Reaktionen und vielen weiteren Reaktionen auftreten. Es wird überwiegend bei Säure-Base-Reaktionen verwendet, bei denen es die Neutralisierung einer anderen Lösung mit der anderen beinhaltet. Grundsätzlich wird eine Standardlösung mit bekannter Konzentration sorgfältig in eine andere Lösung gegossen.
Während des Titrationsprozesses gibt es zwei Stufen, die erreicht werden, nämlich zwei Stufen. Endpunkt- und Äquivalenzpunkt. Der Äquivalenzpunkt, auch als stöchiometrischer Punkt bezeichnet. Die Stufe tritt vor dem Endpunkt auf, der die Fertigstellung der Reaktion signalisiert. Bei einigen Reaktionen könnte es zahlreiche Äquivalenzpunkte geben, insbesondere in polyprotischen Säuren und Basen, an denen mehrere Hydroxidionen existieren.
Dieser Artikel entfaltet den Schlüsselunterschied zwischen Endpunkt und Äquivalenzpunkt in chemischen Titrationen.

Definition des Äquivalenzpunkts
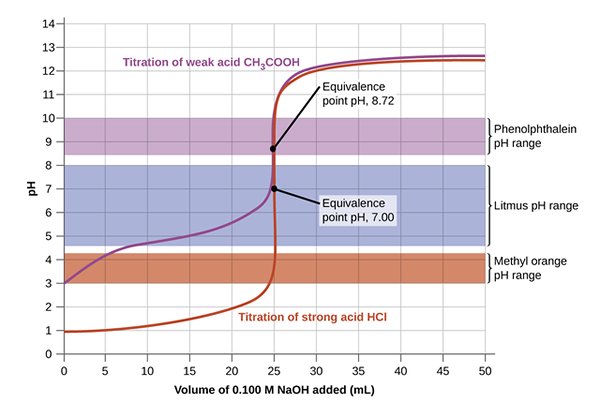
Äquivalenzpunkt in der Titration der Säure-Basis signalisiert die Vervollständigung der Reaktion, bei der die Anzahl der Mol des Titranten und des Analyten wie in der chemischen Gleichung gleich ist. In einer Titration von NaOH und HCl ist beispielsweise 1 Mol HCL genau 1 Mol NaOH am Äquivalenzpunkt entspricht. Dieser Punkt muss genau erreicht werden, indem eine Reihe von Tropfen der Standardlösung für die unbekannte Konzentration verabreicht werden. Eine Pipette wird normalerweise verwendet, um Tropfen des Titrans in den Messkolben zu gießen, in dem der Analyt mit einem bestimmten Indikator gegossen wurde. Indikatoren sind in Säure-Base-Titrationen wichtig, um die Äquivalenz und Endpunkte klar zu erkennen.
Säure- und Basistitration kann zwischen einer starken Basis und einer schwachen Base auftreten; starke Base und schwache Säure; starke Basis und starke Basis; oder schwache polyprotische Säuren. In Abhängigkeit von der typischen Lösung kann ein anderer Indikator verwendet werden, der für die Titration verwendet wird. Zum Beispiel wird in NaOH- und HCl -Titrationen ein Phenolphthalein verwendet, während in NH in NH3 und HCl Ein Methylorange -Indikator ist besser geeignet, Änderungen zu bewirken. Wenn der pH -Wert des Titrans dem pH -Wert am Äquivalenzpunkt entspricht, kann der Endpunkt- und Äquivalenzpunkt gleichzeitig auftreten.
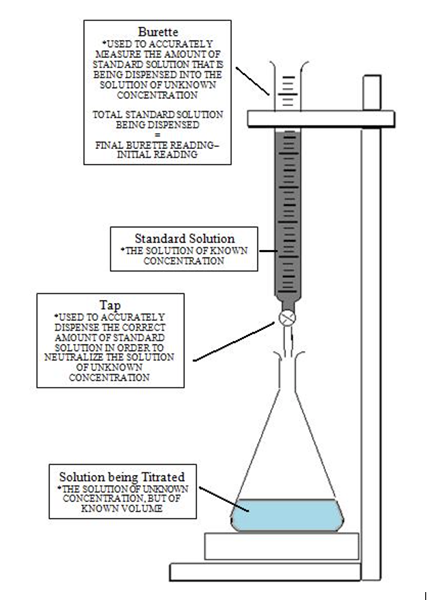
Das folgende Bild vermittelt ein klares Verständnis der Titration, um den Äquivalenzpunkt zu erreichen und später den Endpunkt zu erreichen, wenn sich die Farbe ändert. Zunächst wird die Lösung mit der unbekannten Konzentration mit dem Indikator gegossen. Dann wird das Titrant mit der Bürette hinzugefügt, indem die Tropfen mit dem Ventil gesteuert werden. Die Gleichung mSäureVSäure = MBaseVBase wird verwendet, um die unbekannte Konzentration durch algebraische Manipulationen zu berechnen, die feststellen, dass Molarität eine Reihe von Mol pro Liter ist.
Definition von Endpunkt
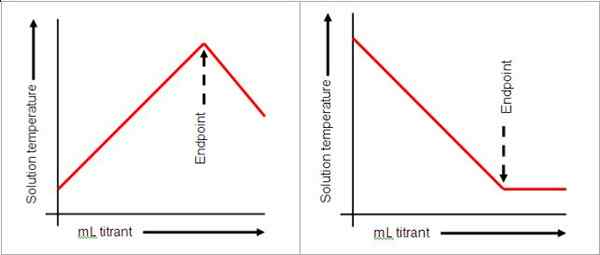
Der Endpunkt kommt nach dem Äquivalenzpunkt in Titrationen. Es zeigt an, dass der Äquivalenzpunkt erreicht wurde. Dieser Endpunkt wird durch die Änderung der Farbe der Lösung angezeigt. Siehe das Bild unten:

Bild mit freundlicher Genehmigung: Chemie Libretextexte
Um den Endpunkt zu erreichen, sollte die Anzahl der Tropfen sorgfältig verabreicht werden, da ein einzelner Tropfen den pH -Wert der Lösung ändern kann. In der Situation, in der der Endpunkt bestanden wurde, kann eine Rückentitration oder eine umgekehrte Titration je nach Art der Lösung durchgeführt werden. Wenn zu viel des Titrants gegossen wurde, könnte der Endpunkt bestanden werden. Die Lösung besteht darin, eine weitere Lösung eines anderen Reaktanten im Übermaß hinzuzufügen.
Indikatoren werden nicht immer in Titrationen verwendet. Die pH -Messgeräte können verwendet werden, um den pH -Wert als Hinweis darauf zu lesen, dass die Reaktion abgeschlossen ist. In einer starken Basis und Säure zeigt ein pH von 7 an, dass die Reaktion vollständig ist. Die Farbänderung ist jedoch eine bequeme Möglichkeit, den Endpunkt zu überwachen, daher werden die Indikatoren häufig verwendet. Eine Lösung von Natriumchlorid und Salzsäure erreicht den Endpunkt, wie durch das Phenolphthalein angezeigt, wenn die Lösung rosa wird. Der Endpunkt zeigt nicht unbedingt das Ende der Reaktion an, sondern den Abschluss der Titration.
Unterschied zwischen Endpunkt und Äquivalenz
Definition von Endpunkt und Äquivalenz
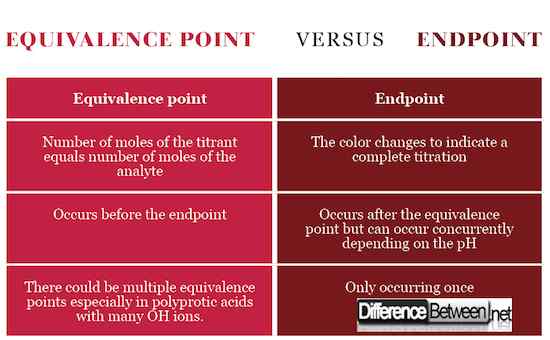
Endpunkt ist die Bühne in der Titration, die durch eine Farbänderung als Zeichen dafür angezeigt wird, dass die Titration vollständig ist und der Äquivalenzpunkt erreicht wurde. Der Äquivalenzpunkt hingegen ist die Bühne kurz vor dem Endpunkt, der den stöchiometrischen Punkt mit gleicher Anzahl von Mol zwischen dem Analyten und dem Titrant in Übereinstimmung mit der chemischen Gleichung signalisiert. Um den Äquivalenzpunkt zu erreichen, muss das Titrant genau gegossen werden.
Auftreten von Endpunkt und Äquivalenz
Der Äquivalenzpunkt tritt auf, wenn die Anzahl der Mol des Titranten, die Standardlösung, gleich der Anzahl der Mol des Analyten ist, die Lösung mit unbekannter Konzentration. Endpunkt tritt auf, wenn sich die Farbänderung ändert.
Bedeutung von Endpunkt und Äquivalenz
Äquivalenzpunkt bedeutet, dass das Titrant vollständig mit dem Analyten reagiert hat, während der Endpunkt die Fertigstellung der Titration signalisiert. Endpunkt und Äquivalenz können gleichzeitig auftreten, wenn der pH -Wert des Titrans dem pH -Wert am Äquivalenzpunkt entspricht.
Endpunktverseäquivalenz: Vergleichstabelle
Zusammenfassung der Äquivalenz der Endpunktverse
- Endpunkt- und Äquivalenzpunkt sind die wichtigsten Phasen in chemischen Titrationen
- Der Endpunkt tritt nach dem Äquivalenzpunkt auf und zeigt den Abschluss der Titration an, jedoch nicht immer das Ende der Reaktion.
- Der Äquivalenzpunkt tritt vor dem Endpunkt auf und zeigt die vollständige Reaktion zwischen dem Titrant und dem Analyten an, bei dem die Anzahl der Mol des Titranten gleich der Anzahl der Mol der unbekannten Konzentration ist
- Der Endpunkt wird erreicht, wenn sich die Farben ändert, wenn der Indikator verwendet wurde
- Andere schwache Säuren können mehrere Äquivalenzpunkte haben, aber nur einen Endpunkt
- Der Äquivalenzpunkt wird auch als stöchiometrischer Punkt bezeichnet
- « Unterschiede zwischen Terminbriefen und Angebotsbriefen
- Unterschiede zwischen Instagram und Twitter »

