Unterschied zwischen Elektrophil und Nucleophil
- 4524
- 620
- Leonhard Lesch
Elektrophil und Nucleophil sind die beiden wichtigen Konzepte in der organischen Chemie, die die chemischen Reaktionen zwischen Elektronenakzeptoren und Spendern beschreiben. Diese beiden Begriffe wurden 1933 von Christopher Kelk Ingold eingeführt und sie dienten als Ersatz für Kationoid- und anionoide Begriffe, die 1925 von einem eingeführt wurden.J. Lapworth.
Seitdem wurden umfangreiche Studien durchgeführt, um den Unterschied zwischen Elektrophil und Nucleophil zu verstehen. Dieser Artikel entmystifiziert den Unterschied zwischen diesen beiden Konzepten. Kurz gesagt, ein Nucleophil ist ein Elektronenspender, während ein Elektrophil ein Elektronenakzeptor ist.
Was ist ein Elektrophiler?
Um den Begriff zu zerkleinern, stammt das Wort „Elektro“ aus Elektronen und das lateinische Wort „Phile“ bezieht sich auf „liebevoll“. In einfachen Worten bedeutet es elektronenliebende. Es ist ein Reagenz, das mit einer geringen Dichte von Elektronen in seiner Valanzschale gekennzeichnet ist und daher mit einem hochdichte Molekül, einem Ionen oder einem Atom reagiert, um eine kovalente Bindung zu bilden. Wasserstoffionen in Säuren und Methylkohlenstoff sind Beispiele für elektrophile Substanzen. Sie sind Elektronenmangel.
Ein Elektrophil kann leicht durch eine positive Ladung oder eine neutrale Ladung mit leeren Orbitalen erkennen (die Oktettregel nicht erfüllen). Elektronen bewegen. Diese Theorie erklärt die Anziehungskraft von Elektronen durch die elektronenmangeler elektrophilen Atome, Moleküle oder Ionen. Per Definition wird ein Elektrophil austauschbar als Lewis -Säure bezeichnet, da es Elektronen im Einklang mit der Definition der Säure akzeptiert.
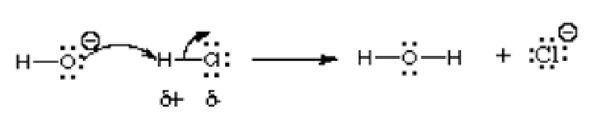
Die Reaktion und Verbindungen unten zeigen die Beispiele von Elektrophilen:

Bei dieser Reaktion reagiert Hydroxidion mit Wasserstoffchlorid; Somit reagiert eine Säure mit einer Base. Wie durch den Pfeil angezeigt, spendet das elektronegativere Sauerstoffatom Elektronen für das Wasserstoffatom mit elektronenmangeligem Wasserstoff. Es teilt ein einziges Paar für das Wasserstoffatom, das eine positive Ladung in dem Wasserstoff -Wasserstoffchlorid trägt, da es elektronegativer ist als Wasserstoff. Diese Reaktion ist eine grundlegende Reaktionen der organischen Chemie, insbesondere Lewis -Säure- und Lewis -Basenreaktionen. Weitere Beispiele sind im folgenden Bild dargestellt:
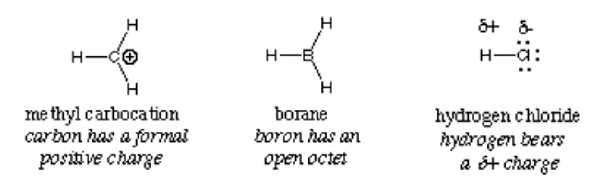
Im Allgemeinen wird ein Elektrophil durch eine teilweise positive Ladung wie bei Wasserstoffchlorid identifiziert, eine formale positive Ladung wie bei Methylcarbokation oder leerer Orbitale. Polarisierte neutrale Moleküle wie Acylhalogenide, Carbonylverbindungen und Alkylhaliden sind typische Beispiele für Elektrophile.
Wichtig: Hydroniumionen, obwohl es eine positive Ladung trägt, qualifiziert sich nicht als Elektrophile aufgrund der vollen freien Orbitale in seiner Außenhülle eingestuft. Es liefert Wasserstoffionen und Wasser. Gleiches gilt für das Ammoniumion; Es gibt keine freien Orbitale, die Elektronen anziehen können. Infolgedessen ist es keine Elektrophile.
Was ist ein Nucleophil?
Der Begriff wird in das Wort „Nucleo“ unterteilt, das sich auf den Kern und das lateinische Wort „Phile“ bezieht, was zu lieben bedeutet. Es bedeutet einfach, dass der Kern liebt. Nucleophile sind reich an Elektronen und spenden wie somit Elektronenpaare an Elektrophile, um kovalente Bindungen bei chemischen Reaktionen zu bilden. Diese Substanzen werden am besten mit Einzelpaaren, PI -Bindungen und negativen Ladungen bemerkt. Ammoniak-, Iodid- und Hydroxidionen sind Beispiele für Nukleophilsubstanzen.
Per Definition wird ein Nucleophil austauschbar als Lewis -Basis bezeichnet, weil sie alle Elektronen spenden und Protonen akzeptieren. Das Bild unten zeigt die Beispiele von Nucleophilen:
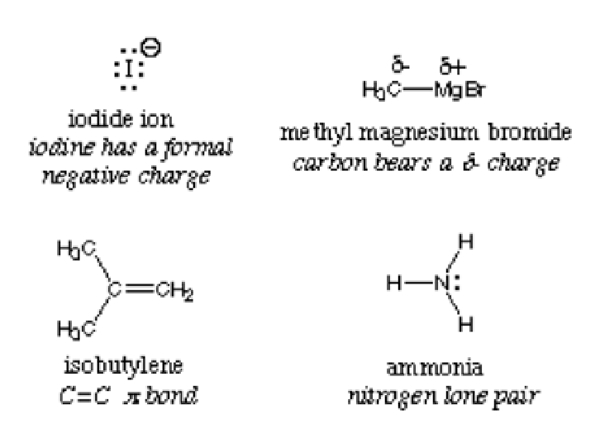
Das nukleophile Zentrum in einer Verbindung wird mit dem elektronegativsten Atom nachgewiesen. Betrachten Sie Ammoniak NH3; Der Stickstoff ist elektronegativer und zieht somit Elektronen in die Mitte. Die Verbindung hat eine hohe Elektronendichte und spendet bei Reaktion mit einem Elektrophilen Wasser Elektronen. H2O kann sowohl als Elektrophil als auch als Nucleophil wirken, abhängig von der Verbindung oder dem Molekül, mit dem es reagiert.
Betrachten Sie das Bild unten:
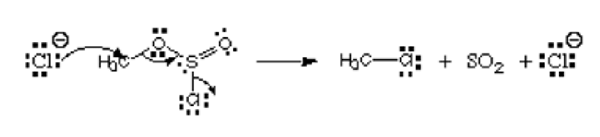
Aus dem Bild spendet das erste Atom, Chloridion sein einsames Paar an Kohlenstoff, um eine kovalente Bindung zu bilden. Es hat die negative Ladung und spendet Elektronen, so wird es als Nucleophil angesehen. Das Chloratom, das den Chlorosulfitester verlässt. Es ist kein Elektrophil oder Nucleophil.
Schlüsselunterschied zwischen Elektrophil und Nucleophil
Definition von Elektrophilen und Nucleophilen
Ein Elektrophil ist eine Lewis-Säure, die Elektronen aus einem elektronenreichen Atom, Ion oder Molekül akzeptiert. Durch die Akzeptanz von Elektronen bildet es eine kovalente Bindung. Dieses Reagenz, das häufig durch teilweise positive Ladung, formale positive Ladung oder ein neutrales Atom, Ion oder Molekül identifiziert wird, das die Oktettregel nicht erfüllt. Ein Nucleophil hingegen ist ein Atom, Ion oder Molekül, das eine hohe Elektronendichte aufweist. Es spendet ein einsames Paar für das Elektrophile, um eine kovalente Bindung zu bilden. Es wird durch positive Gebühren und freie Elektronen in seinem Orbital identifiziert.
Chemische Reaktionen von Elektrophil und Nucleophil
Ein Nucleophil ist an der nukleophilen Substitution und Addition beteiligt, während ein Elektrophil an einer elektrophilen Substitution und Addition beteiligt ist.
Ladung Identität in Elektrophilen und Nucleophilen
Ein Elektrophil kann neutral oder positiv geladen werden, während das Nukleophil neutral oder negativ geladen werden kann. Ein Elektrophil akzeptiert Elektronen, daher wird es als Lewis -Säure bezeichnet, während ein Nucleophil Elektronen spendet, daher wird es als Lewis -Basis bezeichnet.
Elektrophile Verse Nucleophil: Vergleichstabelle

Zusammenfassung von elektrophilen Versen Nucleophil
- Ein Elektrophil ist ein elektronenmangelhaftes Atom, Ion oder Molekül
- Ein Elektrophil kann positiv oder neutral geladen werden, während das Nucleophil negativ oder neutral geladen werden kann
- Ein Elektrophil wird als Lewis -Säure bezeichnet und das Nucleophil wird als Lewis -Base bezeichnet
- Ein Elektrophil akzeptiert Elektronen und spendet Protonen, während ein Nucleophil Elektronen spendet und Protonen akzeptiert.
- « Unterschied zwischen PowerShell und CMD
- Unterschied zwischen Open Source und Proprietary Software »

