Differenz zwischen Bindungsenergie und Bindungsdissoziationsenergieenthalpie
- 1949
- 3
- Justus Dengler
Bondergie vs. Bindungsdissoziationsenergie (Enthalpie)
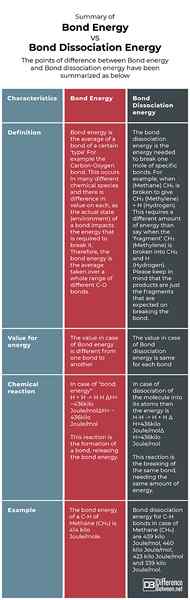
Bindungsenergie ist der Durchschnittswert der Gasphasenbindungsdissoziationsenergien (normalerweise bei einer Temperatur von 298 K), die zwischen denselben Atomenarten bestehen. Die Energie- und Bindungsdissoziationsenergie sind jedoch nicht gleich. Bindungsdissoziationsenergie ist die Standardänderung der Enthalpie, wenn eine kovalente Bindung (auch als molekulare Bindung bezeichnet wird, eine chemische Bindung zwischen zwei nichtmetallischen Atomen ist, die die Teile von Elektronenpaaren zwischen diesen Atomen beinhaltet Stücke) Fragmente geben; die normalerweise radikale Arten sind. Daher besteht die Hauptdifferenz zwischen Bindungsenergie und Bindungsdissoziationsenergie darin, dass die Bindungsenergie ein Durchschnittswert ist, während Bindungsdissoziationsenergie für eine bestimmte Bindung ein bestimmter Wert ist.
Was ist Bindungsergie und Bindungsdissoziationsenergie (Enthalpie)?
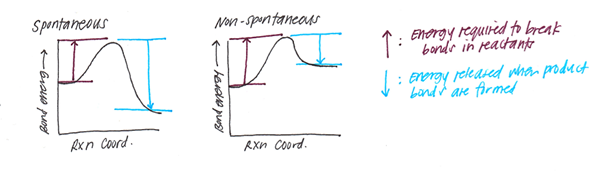
Bindungsenergie
Bindungsenergie bezieht sich auf die Energie, die erforderlich ist, um alle Bindungen zwischen denselben 2 -Art chemischen Spezies in einer Verbindung abzubauen.
Ein Diagramm der potentiellen Energie eines 2-Atom-Systems und der Abstand zwischen den chemischen Spezies zeigt den Abstand, in dem die Energie zu weniger ist. Diese Entfernung ist die Bindungslänge zwischen den Atomen.
Je höher die mit einem spezifischen chemischen Spezies verbundene Bindungsenergie (e), desto stärker ist die Bindung und weniger der Abstand zwischen den 2 Atomen.
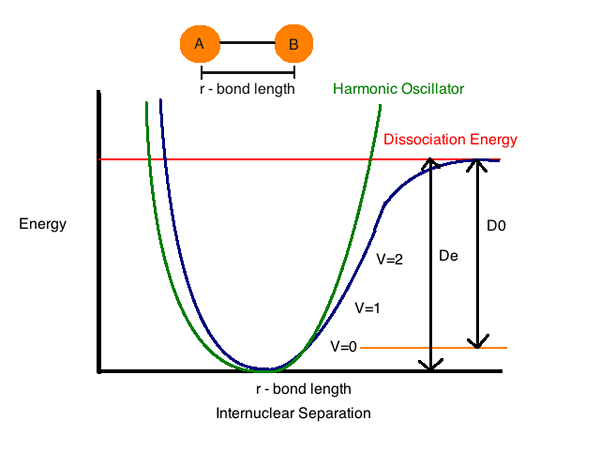
Bindungsdissoziationsenergie
Bindungsdissoziationsenergie (Enthalpie) (H) ist die Energiemenge, die für den Abbau einer bestimmten Bindung in der Homolyse erforderlich ist. Wir können es als die Enthalpieänderung definieren, die stattfindet, wenn eine Bindung durch Homolyse spaltet. Die Dissoziationsenergie der Bindung ist spezifisch für eine einzige Bindung.
Anleiheenthalpie (thermodynamische Eigenschaft eines Systems) oder eine Bindungsdissoziationsenergie als Standard -Enthalpieänderung bezeichnet, wenn eine Bindung durch Homolysen (in kleine Stücke zerlegt) mit Reaktanten und Produkten der Homolysereaktion bei gespalten (getrennt oder geteilt) wird 0 K (absolute Null).
Differenz zwischen Bindungsenergie und Bindungsdissoziationsenergie (Enthalpie)
Beschreibung
Bindungsenergie
Bindungsenergie wird auch als Bindungsenthalpie bezeichnet und als Maß für die Bindungsstärke in einer chemischen Bindung definiert. Bindungsenergie ist ein Durchschnittswert
Bindungsdissoziationsenergie
Bindungsdissoziationsenergie ist definiert als die Standardänderung der Enthalpie, die erforderlich ist, um eine chemische Bindung zu brechen
Produkt
Bindungsenergie
Bond -Energie bietet die Energie, die zur Bildung der Atome erforderlich ist, die das Ausgangsmaterial für die Bildung von Bindungen sind.
Bindungsdissoziationsenergie
Bindungsdissoziationsenergie sorgte für die Energie, die zur Bildung freier Radikale aus den Atomen erforderlich ist, die diese bestimmte Bindung erzeugen.
Beispiel
Bindungsenergie
In der Chemie ist die Bindungsenergie (E) oder die Bindungsenthalpie (H) das Maß für die Bindungsstärke in einer chemischen Bindung.… Zum Beispiel ist die (c-H) Kohlenstoffhydrogenbindungsenergie in Methan (CH4) die Enthalpieänderung, die mit dem Aufbrechen eines Moleküls von CH4 in ein Kohlenstoffatom (C) und vier Wasserstoff (H) -Radikalen geteilt durch vier beteiligt ist.
Bindungsdissoziationsenergie
Zum Beispiel im Methanmolekül betragen Bindungsdissoziationsenergien für C-H-Bindungen 439 kJ/mol, 460 kJ/mol, 423 kJ/mol und 339 kJ/mol. Die Bindungsenergie des C-H von Methan beträgt jedoch 414 kJ/mol, was der Durchschnitt aller vier Werte ist. Darüber hinaus ist für ein Molekül die Bindungsdissoziationsenergie möglicherweise nicht unbedingt gleich der Bindungsenergie (wie für das oben gegebene Beispiel für Methan)). Für ein zweidomisches Molekül sind Bindungsenergie und die Bindungsdissoziationsenergie gleich.
Symbol
Bindungsenergie
Es wird mit e bezeichnet
Bindungsdissoziationsenergie
Es wird mit H bezeichnet
Bindungsbildung
Bindungsenergie
Es gibt die Energie, die erforderlich ist, um die Atome zu bilden, die das Ausgangsmaterial für die Bindungsbildung waren
Bindungsdissoziationsenergie
Es gibt die Energie, die erforderlich ist, um freie Radikale aus den Atomen zu erzeugen, die diese bestimmte Bindung erzeugt haben
Zusammenfassung der Bond -Energie vs. Bindungsdissoziationsenergie
Die Differenzpunkte zwischen Bindungsenergie und Bindungsdissoziationsenergie wurden wie unten zusammengefasst:
- « Unterschied zwischen der Zuständigkeit der Gegenstand und der persönlichen Zuständigkeit
- Unterschied zwischen Klimawandel und Ozonabbau »

