Kovalente Bindungen vs. Ionische Bindungen
- 2007
- 578
- Milana Battke
Es gibt zwei Arten von Atombindungen - ionische Bindungen Und kovalente Bindungen. Sie unterscheiden sich in ihrer Struktur und Eigenschaften. Kovalente Bindungen bestehen aus Elektronenpaaren, die von zwei Atomen geteilt werden, und binden die Atome in einer festen Ausrichtung. Relativ hohe Energien sind erforderlich, um sie zu brechen (50 - 200 kcal/mol). Ob zwei Atome eine kovalente Bindung bilden können, hängt von ihrer Elektronegativität ab i ab.e. Die Leistung eines Atoms in einem Molekül, um Elektronen für sich selbst anzulocken. Wenn sich zwei Atome in ihrer Elektronegativität erheblich unterscheiden - wie Natrium und Chlorid -, verliert einer der Atome sein Elektron an das andere Atom. Dies führt zu einem positiv geladenen Ion (Kation) und einem negativ geladenen Ion (Anion). Die Bindung zwischen diesen beiden Ionen wird als als bezeichnet Ionenverbindung.
Vergleichstabelle
| Kovalente Bindungen | Ionische Bindungen | |
|---|---|---|
| Was ist es? | Die kovalente Bindung ist eine Form der chemischen Bindung zwischen zwei nicht metallischen Atomen, die durch das Teilen von Elektronenpaaren zwischen Atomen und anderen kovalenten Bindungen gekennzeichnet sind. | Die ionische Bindung, auch als elektrisch bekannt. Diese Art von Bindungen treten hauptsächlich zwischen einem metallischen und einem nicht metallischen Atom auf. |
| Formation | Zwischen zwei Nichtmetallen, die ähnliche Elektronegativitäten aufweisen, wird eine kovalente Bindung gebildet. Kein Atom ist "stark" genug, um Elektronen aus dem anderen anzulocken. Zur Stabilisierung teilen sie ihre Elektronen aus der äußeren molekularen Umlaufbahn mit anderen. | Es wird eine ionische Bindung zwischen einem Metall und einem Nichtmetallgebiet gebildet. Nicht-Metalle (-Ve-Ion) sind "stärker" als das Metall (+ve Ion) und können Elektronen sehr leicht aus dem Metall bekommen. Diese beiden entgegengesetzten Ionen ziehen sich an und bilden die ionische Bindung. |
| Tritt zwischen | Zwei Nichtmetalle | Ein Metall und ein Nichtmetall |
| Elektronen | Elektronen werden in kovalenten Bindungen geteilt. | In ionischen Bindungen werden Elektronen von einem Atom zum anderen übertragen, was zu zwei geladenen Ionen führt - eines positiv geladen und eine negativ geladen. Die beiden Ionen werden voneinander angezogen und bilden eine ionische Bindung. |
| Beispiele | Methan (CH4), Hydro -Chlorsäure (HCl) | Natriumchlorid (NaCl), Schwefelsäure (H2SO4) |
| Schmelzpunkt | Niedrig | Hoch |
| Sich in Wasser auflösen? | Variiert | Ja |
| Polarität | Niedrig | Hoch |
| Form | Bestimmte Form | Keine bestimmte Form |
| Siedepunkt | Niedrig | Hoch |
| Zustand bei Raumtemperatur | Flüssig oder gasförmig | Solide |
| Konsistenz | Weich | Spröde |
Über kovalente und ionische Bindungen
Die kovalente Bindung wird gebildet, wenn zwei Atome Elektronen teilen können.
Jedes Atom besteht aus Protonen, Neutronen und Elektronen. Im Zentrum des Atoms bleiben Neutronen und Protonen zusammen. Aber Elektronen drehen sich um die Umlaufbahn um das Zentrum. Jede dieser molekularen Umlaufbahnen kann eine bestimmte Anzahl von Elektronen haben, um ein stabiles Atom zu bilden. Abgesehen von Inertgas ist diese Konfiguration jedoch nicht bei den meisten Atomen vorhanden. Um das Atom zu stabilisieren, teilt jedes Atom die Hälfte seiner Elektronen.
Die kovalente Bindung ist eine Form der chemischen Bindung zwischen zwei nicht metallischen Atomen, die durch das Teilen von Elektronenpaaren zwischen Atomen und anderen kovalenten Bindungen gekennzeichnet sind. Die ionische Bindung, auch als elektrisch bekannt. Diese Art von Bindungen tritt hauptsächlich zwischen einem metallischen und einem nicht metallischen Atom auf.
Bildung und Beispiele
Kovalente Bindungen werden infolge des Teilens eines oder mehrerer Paare von Bindungselektronen gebildet. Die Elektro -Negativitäten (Elektronenerziehungsfähigkeit) der beiden gebundenen Atome sind entweder gleich oder die Differenz ist nicht größer als 1.7. Solange der Unterschied der Elektro-Negativität nicht größer als 1 ist.7 Die Atome können die Verbindungselektronen nur teilen.
 Ein Modell der doppelten und einzelnen kovalenten Kohlenstoffbindungen in einem Benzolring.
Ein Modell der doppelten und einzelnen kovalenten Kohlenstoffbindungen in einem Benzolring. Betrachten wir zum Beispiel ein Methanmolekül I.e.CH4. Carbon hat 6 Elektronen und seine elektronische Konfiguration ist 1S22S22P2, i.e. Es hat 4 Elektronen in seiner äußeren Umlaufbahn. Gemäß der Oktatregel (es heißt, dass Atome Elektronen tendieren, zu gewinnen, zu verlieren oder zu teilen.) Um in einem stabilen Zustand zu sein, benötigt es 4 weitere Elektronen. So bildet es eine kovalente Bindung mit Wasserstoff (1S1) und bildet Elektronen mit Wasserstoff Methan oder CH4.
Wenn der Differenz der Elektro-Negativität größer als 1 ist.7 Dann hat das höher elektronegative Atom eine Elektronenanziehungsfähigkeit, die groß genug ist, um die Übertragung von Elektronen aus dem kleineren elektronegativen Atom zu erzwingen. Dies führt zur Bildung ionischer Bindungen.
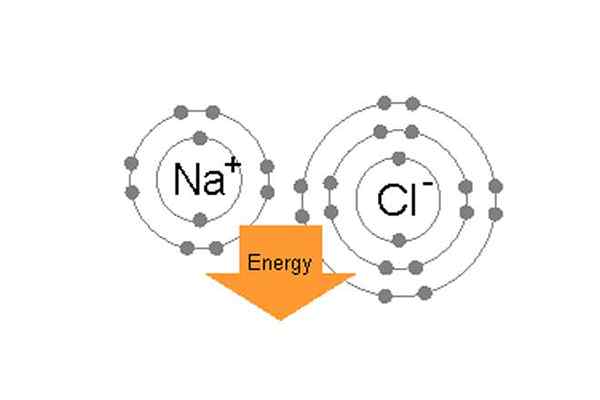
 Natrium- und Chlorbindung ionisch zur Bildung von Natriumchlorid.
Natrium- und Chlorbindung ionisch zur Bildung von Natriumchlorid. Zum Beispiel sind die einzelnen Atome in gemeinsamem Tischsalz (NaCl) Natrium und Chlor. Chlor hat sieben Valenzelektronen in der Außenumlaufbahn, aber um sich in einem stabilen Zustand zu befinden. Andererseits hat Natrium ein Valenzelektron und benötigt auch acht Elektronen. Da Chlor eine hohe Elektro-Negativität hat, 3, 3.16 im Vergleich zu Natriums 0.9, (der Unterschied zwischen ihrer Elektro-Negativität beträgt mehr als 1.7) Chlor kann leicht Natriums ein Valenzelektron anziehen. Auf diese Weise bilden sie eine ionische Bindung und teilen sich gegenseitig die Elektronen und beide haben 8 Elektronen in ihrer Außenhülle.
Eigenschaften der Bindungen
Kovalente Bindungen haben eine bestimmte und vorhersehbare Form und haben niedrige Schmelz- und Siedepunkte. Sie können leicht in seine Primärstruktur eingebrochen werden, da die Atome in der Nähe der Elektronen in der Nähe sind. Diese sind meist gasförmig und sogar eine leichte negative oder positive Ladung an den entgegengesetzten Enden einer kovalenten Bindung verleiht ihnen eine molekulare Polarität.
Ionenbindungen bilden normalerweise kristalline Verbindungen und haben höhere Schmelzpunkte und Siedepunkte im Vergleich zu kovalenten Verbindungen. Diese leiten Elektrizität im geschmolzenen oder Lösungszustand und sind extrem polare Bindungen. Die meisten von ihnen sind in Wasser löslich, aber in nicht-polaren Lösungsmitteln unlöslich. Sie benötigen viel mehr Energie als kovalente Bindung, um die Bindung zwischen ihnen zu brechen.
Der Grund für den Unterschied in den Schmelz- und Siedepunkten für ionische und kovalente Bindungen besteht darin.

