Allotrope vs. Isomere

- 3956
- 236
- Hugo Poehn
Allotrope sind unterschiedliche strukturelle Modifikationen eines Elements, während Isomere sind chemische Verbindungen, die dieselbe molekulare Formel haben, aber unterschiedliche Strukturformeln aufweisen.
Bestimmte Elemente können in zwei oder mehr verschiedenen Formen existieren. Diese Formen werden genannt Allotrope in denen die Atome des Elements auf andere Weise miteinander verbunden sind. Zum Beispiel Dioxygen (o2), Ozon (o3), Tetraoxygen (o4) und Oktaoxygen (o8) sind Sauerstoffallotrope. Ein weiteres Beispiel ist Kohlenstoff, dessen Allotrope Graphit und Diamant umfassen. Kurzer.
Im Gegensatz, Isomere sind Verbindungen (Siehe Elemente vs. Verbindungen), die die gleiche molekulare Formel haben, aber unterschiedliche strukturelle Formeln haben. Isomere teilen ihre chemischen Eigenschaften nicht, es sei denn, sie gehören zur gleichen funktionellen Gruppe. Zum Beispiel hat Propanol die Formel C3H8O (oder c3H7OH) und tritt als zwei Isomere auf: propan-1-ol (N-Propylalkohol; ICH) und propan-2-ol (Isopropylalkohol; Ii). Der Unterschied zwischen den beiden Isomeren liegt in der Position des Sauerstoffatoms. Es gibt ein drittes Isomer von C3H8O Wessen Eigenschaften sind so unterschiedlich, dass es kein Alkohol ist (wie Propanol), sondern ein Äther. Methoxyethan genannt (Methylethylether; III) Dieses Isomer hat einen Sauerstoff, der mit zwei Kohlenstoffen verbunden ist und nicht mit einem Kohlenstoff und einem Wasserstoff.
Vergleichstabelle
| Allotrope | Isomere | |
|---|---|---|
| Definition | Allotrope sind unterschiedliche strukturelle Modifikationen eines Elements. Zum Beispiel O und O2 | Isomere sind chemische Verbindungen, die dieselbe molekulare Formel haben, aber unterschiedliche Strukturformeln aufweisen. |
| Beispiele | Diamant, Graphit usw. | 2-methylpropan-1-ol und 2-methylpropan-2-ol. |
Geschichte von Allotrömen und Isomeren
Sowohl Allotropie als auch Isomerismus waren Konzepte, die der schwedische Wissenschaftler Jöns Jakob Berzelius vorgeschlagen hatte. Er schlug das Konzept von vor Allotropie 1841. Nach der Akzeptanz von Avogadros Hypothese im Jahr 1860 wurde verstanden2 und o3. Im frühen 20. Jahrhundert wurde erkannt, dass andere Fälle wie Kohlenstoff auf Unterschiede in der Kristallstruktur zurückzuführen waren.
Der Isomerismus wurde erstmals 1827 bemerkt, als Friedrich Wöhller Cyansäure herstellte und feststellte, dass seine Elementarzusammensetzung zwar mit Fulminsäure identisch war (hergestellt von Justus von Liebig im Vorjahr), waren seine Eigenschaften jedoch sehr unterschiedlich. Dieser Befund stellte das vorherrschende chemische Verständnis der Zeit in Frage, was der Ansicht war, dass chemische Verbindungen nur dann unterschiedlich sein könnten, wenn sie unterschiedliche Elementzusammensetzungen hatten. Nach zusätzlichen Entdeckungen derselben Art, wie beispielsweise Weehlers Entdeckung von 1828, dass Harnstoff die gleiche Atomzusammensetzung wie das chemisch unterschiedliche Ammoniumcyanat hatte, führte Jakob Berzelius den Begriff vor Isomerismus das Phänomen beschreiben.
Arten von Isomeren
Verschiedene Klassen von Isomeren umfassen Stereoisomere, Enantiomere und geometrische Isomere.
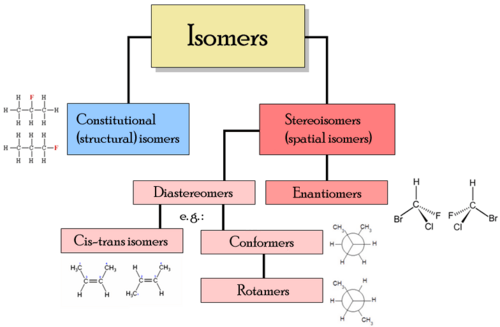 Arten von Isomeren
Arten von Isomeren - Strukturelle Isomere - In strukturellen Isomeren werden die Atome und funktionellen Gruppen auf unterschiedliche Weise miteinander verbunden. Zu den Arten von strukturellen Isomeren gehören:
- Kettenisomerismus - Kohlenwasserstoffketten haben variable Verzweigungen
- Positionieren Sie den Isomerismus - befasst sich mit der Position einer funktionellen Gruppe in einer Kette
- Funktionsgruppe Isomerismus - Eine funktionale Gruppe wird in verschiedene aufgeteilt.
- Skelettisomere - Die Hauptkohlenstoffkette unterscheidet sich zwischen den beiden Isomeren.
- Tautomere - strukturelle Isomere derselben chemischen Substanz, die spontan miteinander umgeht.
- Stereoisomere - In Stereoisomeren ist die Bindungsstruktur gleich, aber die geometrische Positionierung von Atomen und funktionellen Gruppen im Raum ist unterschiedlich. Zu Stereoisomeren gehören:
- Enantiomere - Verschiedene Isomere sind nicht übereinstimmbare Spiegelbilder voneinander
- Diastereomere - Isomere sind keine Mirro -Bilder voneinander

