Der Unterschied zwischen Erguss und Diffusion
- 4936
- 312
- Caitlin Rodehau
Wenn Sie sich die Periodenschaftstabelle der Elemente ansehen, können Sie zahlreiche Substanzen sehen, aus denen die Umgebung besteht. Es ist so erstaunlich zu wissen, dass alles aus einer kleinen identifizierbaren Einheit besteht, die als Moleküle bekannt ist. Diese Moleküle bestehen aus Atomen, die durch chemische Bindungen gehalten werden. Diese Bindungen sind das Ergebnis des Austauschs oder der Teilen von Elektronen (negativ oder positiv subatomare Teilchen) zwischen Atomen.
Wenn es um Gase geht, bewegen sich ihre Moleküle auf jeden Fall. In den 19. Jahrhundert wurde die kinetische Molekulartheorie von zwei Wissenschaftlern formuliert: James Maxwell und Ludwig Boltzman. Sie erklärten, wie sich Gase verhalten und mit vier Postulaten herauskamen, die die Theorie erzählen. Die Folgenden sind:
- Die Gasemoleküle sind in einer ständigen Bewegung und die Kollision zwischen Gasmolekülen und Behälterwänden verursacht Druck.
- Die Gaspartikel interagieren nicht miteinander. Es gibt weder abstoßende noch attraktive Kraft.
- Die Kelvin -Temperatur ist direkt proportional zur durchschnittlichen kinetischen Energie.
- Die Gasenpartikel sind im Vergleich zu dem Volumen, das sie besetzen, so gering, daher wird angenommen, dass die Partikel kein Volumen haben.
Darüber hinaus formalte Thomas Graham, ein schottischer Chemiker, wie sich Gase bewegen. Somit regelt das Graham -Gesetz das Erguss- und Diffusionsphänomen. Beachten Sie jedoch, dass diese Begriffe nicht nur in der Chemie eingeschlossen sind, sondern auch in vielen Wissenschaften wie Physik und Biologie häufig verwendet werden. In Bezug. Sie unterscheiden sich jedoch völlig voneinander.
 Erguss
Erguss
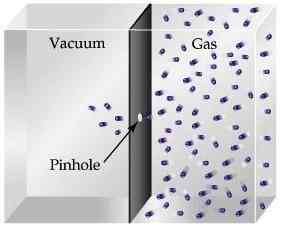
Der Erguss wird als Bewegung oder Flucht von Gasmolekülen durch ein Loch in ein Vakuum beschrieben.
Auf der oben diskutierten Theorie basiert ein leichteres Gas mit größerer Geschwindigkeit im Vergleich zu schwereren, da die Moleküle mit dem Loch kollidieren, was dazu führt, dass mehr Partikel in der Einheitszeit durchfließen.
Dies wird durch das Gesetz von Graham quantitativ - die molekulare Bewegung ist umgekehrt proportional zur Quadratwurzel ihrer Molmasse.
Ein perfektes Beispiel für den Erguss ist das Phänomen, das mit aufgeblasenen Luftballons auftritt. Haben Sie jemals bemerkt, wie sich ein Ballon über einen bestimmten Zeitraum hinweg entleert? Nun, das liegt daran.
 Diffusion
Diffusion
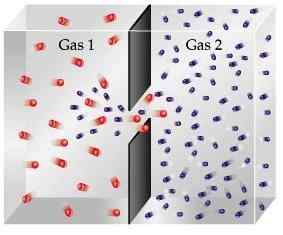
Die Diffusion stammt aus dem lateinischen Wort "diffundere", was bedeutet, sich „auszubreiten“. In der Chemie wird die Diffusion als allmähliche Mischung von Gasen beschrieben. Es ist die Bewegung eines Gases durch ein anderes durch eine thermische Zufallsbewegung, die dazu führt.
Es ist ein allmählicher Prozess, der dazu führt. Dies tritt kontinuierlich auf und stoppt nur, wenn die Moleküle gleichmäßig ausbreiten.
Der einfachste Weg, die Diffusion zu verstehen, ist, wenn eine Flasche Parfüm geöffnet wird. Der Duft reist und breitete sich in die umgebende Luft aus. Der allmähliche Duft, der sich mit der Luft mischt. Gleiches passiert, wenn ein bestimmter einzelnen Furz, der schädliche Geruch mit der Luft diffundiert, und früher oder später werden die Leute es riechen. Vermeiden Sie also das Furz an öffentlichen Orten.
Letzter Gedanke!
Diffusion und Erguss spielen in unserem Alltag eine wichtige Rolle. Tatsächlich ist Diffusion ein häufiger Prozess, der im Körper auftritt. Es ist der Prozess, der zwischen dem Austausch von Nährstoffen, Energie und Sauerstoff in unseren Systemen auftritt. Es ist ziemlich informativ zu wissen, wie sich Elemente bewegen und den genauen Unterschied zwischen Erguss und Diffusion kennen.

