Unterschied zwischen schwacher und starker Basis
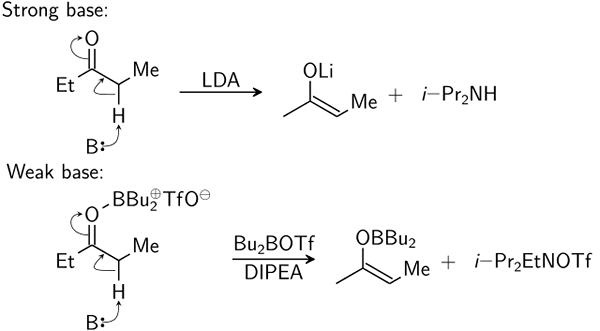
- 3988
- 1125
- Justus Dengler
In der zeitgenössischen Chemie werden verschiedene Definitionen einer Basis verwendet:
- Arrhenius -Basis - eine Substanz, die die Konzentration von Hydroxidanionen erhöht, wenn sie in Wasser gelöst sind;
- Basis von Brønsted -Lowry - eine Substanz, die bei Reaktion mit Säure Proton aufnimmt;
- Lewis Base - eine Substanz, die ein Elektronenpaar einer anderen Substanz ergibt, wenn sie mit Säure reagiert.
Am weitesten verbraucht ist die Definition des Brøndsted-Lowry.
Basen im breiten Sinne umfassen drei Gruppen von Substanzen:
- Wasserlösliche Metallhydroxide: Naoh, CA (OH)2, usw.;
- Wasserunlösliche Oxide oder Hydroxide, die mit Säure reagieren können: Feo, AL (OH)3, usw.;
- Andere Verbindungen, die, wenn sie in Wasser gelöst sind, mit ihm interagieren und Hydroxidionen freisetzen: NH3, CH3NH2, usw.
Einige der allgemeinen Eigenschaften der Basen sind:
- Seife oder schleimige Berührung;
- Bitterer Geschmack;
- Elektrische Leitfähigkeit;
- Gewaltsame Reaktion mit reduzierbaren oder sauren Substanzen; ätzend in der organischen Substanz;
- Rotes Lackmuspapier blau machen.
Was ist schwache Basis?
Schwache Basen dissoziieren nur teilweise, um Ionen in Lösung zu geben.
Wenn eine Basis ionisiert, hinterlässt es ein OH- Ion dahinter, indem Sie ein Wasserstoffionen aus dem Wasser aufnehmen. Die Lösungen schwacher Basen haben eine höhere h+ Konzentration als die von starken Stützpunkten.
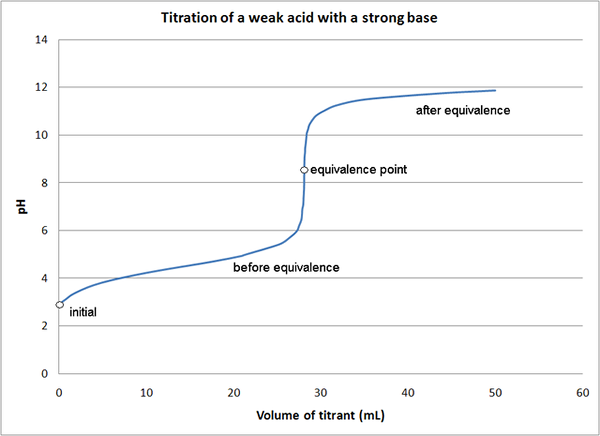
Die Basizität einer wässrigen Lösung wird durch pH angegeben.
PH = -Log10 [H+]
Der pH -Wert der Basen ist höher als 7.3. Schwach werden bedingt als die Basen mit pH unter 10 betrachtet.
Da Basen Protonenakzeptoren sind, erhält die Basis eine OH- Ion aus Wasser. Schwache Basen sind weniger vollständig protoniert als stärkere Basen und haben daher einen höheren H+ Konzentration in der Lösung. Höher h+ Die Konzentration führt zu einem niedrigeren pH -Wert.
In Wasserlösung existieren die Basen im chemischen Gleichgewicht. Die Position des Gleichgewichts variiert je nach Festigkeit der Basis. Je schwächer die Basis, desto weiter links wird das Gleichgewicht verschoben.
Die Position des Gleichgewichts wird durch die Gleichgewichtskonstante (KB) gemessen. Je mehr das Gleichgewicht links liegt, desto niedriger ist der Wert für die Konstante. Die schwächeren Basen haben also niedrigere Gleichgewichtskonstanten.
Die schwachen Basen sind schwache Elektrolyte.
Die Fähigkeit einer Lösung, Elektrizität zu leisten, hängt von der Konzentration von Ionen ab. Die Lösung einer schwachen Basis hat weniger Ionen als eine Lösung eines starken und daher eine geringere elektrische Leitfähigkeit.
Beispiele für schwache Basen sind:
- Alanine (c3H5Ö2NH2);
- Ethylamin (c2H5NH2);
- Dimethylamin ((ch)3)2NH);
- Methylamin (Ch3NH2);
- Glycin (c2H3Ö2NH2);
- Trimethylamin ((ch)3)3N);
- Hydrazin (n2H4).

Was ist starke Basis?
Starke Grundlagen vollständig dissoziieren, um Ionen in Lösung zu geben. Sie haben einen pH zwischen 10 und 14.
Starke Grundlagen sind für lebende Gewebe ätzend und können einen schwerwiegenden Einfluss haben. Häufige Beispiele für starke Basen sind die Hydroxide von Alkali und alkalischen Erdmetallen.
Sehr starke Basen können schwache saure C-H-Gruppen selbst in Abwesenheit von Wasser deprotonieren.
Die starken Basen haben eine höhere Gleichgewichtskonstante im Vergleich zu den schwächeren.
Die starken Grundlagen sind hochreaktiv. Sie sind gute Elektrolyte.
Die Fähigkeit einer Lösung, Elektrizität zu leisten, hängt von der Konzentration von Ionen ab. Eine starke Basis hat mehr Ionen in der Lösung als eine schwache, daher hat sie eine höhere elektrische Leitfähigkeit.
Beispiele für starke Basen sind:
- Strontiumhydroxid (SR (OH)2);
- Bariumhydroxid (BA (OH)2);
- Calciumhydroxid (CA (OH)2);
- Natriumhydroxid (NaOH);
- Cäsiumhydroxid (CSOH);
- Kaliumhydroxid (KOH).
Unterschied zwischen schwacher und starker Basis
-
Definition
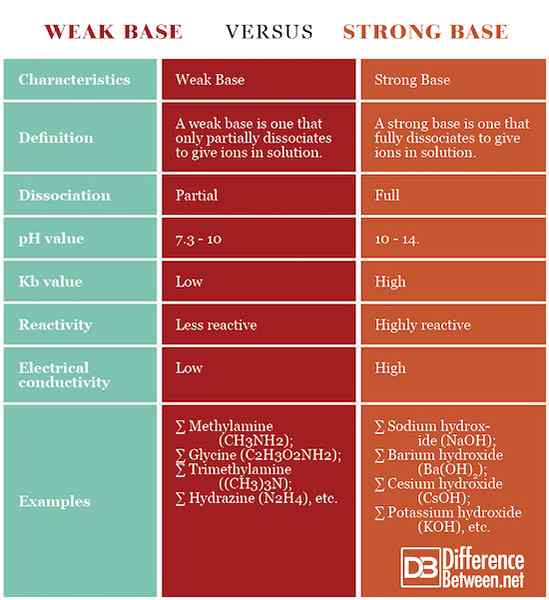
Schwache Basis: Eine schwache Basis ist eine, die nur teilweise dissoziiert, um Ionen in Lösung zu geben.
Starke Basis: Eine starke Basis ist eine, die sich vollständig dissoziiert, Ionen in Lösung zu geben.
-
Dissoziation
Schwache Basis: Schwache Basen dissoziieren nur teilweise in Lösung.
Starke Basis: Starke Grundlagen in Lösung vollständig dissoziieren.
-
PH Wert
Schwache Basis: Schwache Basen haben pH 7.3 - 10.
Starke Basis: Starke Basen haben einen pH 10 - 14.
-
KB -Wert
Schwache Basis: Die schwachen Basen haben im Vergleich zu den starken niedrigere Gleichgewichtskonstanten.
Starke Basis: Die starken Basen haben eine höhere Gleichgewichtskonstante im Vergleich zu den Schwachen.
-
Reaktivität
Schwache Basis: Schwache Basen sind weniger reaktiv als die starken.
Starke Basis: Starke Basen sind hochreaktiv.
-
Elektrische Leitfähigkeit
Schwache Basis: Die Lösung einer schwachen Basis hat eine geringere elektrische Leitfähigkeit als die einer starken Basis.
Starke Basis: Die Lösung einer starken Basis hat eine höhere elektrische Leitfähigkeit als die einer schwachen Basis.
-
Beispiele
Schwache Basis: Beispiele für schwache Basen sind Methylamin (CH3NH2), Glycin (C2H3Ö2NH2), trimethylamin ((ch)3)3N), Hydrazin (n2H4), usw.
Starke Basis: Beispiele für starke Basen sind Natriumhydroxid (NaOH), Cäsiumhydroxid (CSOH), Kaliumhydroxid (KOH), Bariumhydroxid (BA (OH)2), usw.
Schwach gegen. Starke Basis: Vergleichstabelle
Zusammenfassung von schwachen vs. Starke Basis
- Nach der Definition von Brønsted-Lowry ist eine Basis eine Substanz, die Protonen aufnimmt, wenn sie mit Säure reagiert.
- Die Basen haben Seifen oder schleimige Berührung und bitteren Geschmack. Sie reagieren heftig mit reduzierbaren oder sauren Substanzen und sind auf organische Substanz ätzend.
- Eine schwache Basis ist eine, die nur teilweise dissoziiert, um Ionen in Lösung zu geben.
- Eine starke Basis ist eine, die sich vollständig dissoziiert, Ionen in Lösung zu geben.
- Schwache Basen dissoziieren nur teilweise in einer Lösung, während die starken Basen in einer Lösung vollständig dissoziieren.
- Schwache Basen haben pH 7.3 - 10, starke haben einen pH 10 - 14.
- Die schwachen Basen haben eine niedrigere Gleichgewichtskonstante, während die starken Basen eine höhere Gleichgewichtskonstante aufweisen.
- Starke Basen sind hochreaktiv, während schwache Basen weniger reaktiv sind.
- Die Lösung einer schwachen Basis hat eine geringere elektrische Leitfähigkeit als die einer starken Basis.
- Beispiele für schwache Basen sind Methylamin (CH3NH2), Glycin (C2H3Ö2NH2), trimethylamin ((ch)3)3N), Hydrazin (n2H4), usw. Beispiele für starke Basen sind Natriumhydroxid (NaOH), Bariumhydroxid (BA (OH)2), Cäsiumhydroxid (CSOH), Kaliumhydroxid (KOH) usw.

