Unterschied zwischen dem flüssigen Zustand und dem gasförmigen Zustand
- 3410
- 439
- Leonhard Lesch
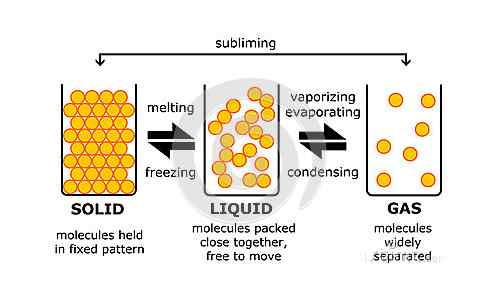
Alles, was physisch existiert und die Messe hat, wird als Materie definiert. Zum Beispiel ist Ihre Wasserflasche Materie und das Wasser darin auch. Die Faulheit, die Sie am Morgen oder Gedanken, die Sie in Ihrem Kopf haben. Nachdem wir wissen, was wichtig ist, können wir dies ergänzen, indem wir sagen, dass es vier Staaten gibt. Dies sind Plasma, feste, flüssige und gasförmige Zustände. Die letzten drei sind die grundlegenden oder konventionellen Materiezustände. Fast alles, was als Materie eingestuft wird, kann in einen dieser drei Zustände umgewandelt werden, solange bestimmte Bedingungen erfüllt sind. Dies können Druckänderungen, Temperaturen usw. umfassen. Beachten Sie, dass zwar fast alle Materie von einem Zustand in den anderen umgewandelt werden können, bei Raumtemperatur einen bestimmten Zustand benötigt. Zum Beispiel ist H2O die chemische Formel für Wasser, die im flüssigen Zustand bei Raumtemperatur vorhanden ist, aber auch zu Eis (Feststaat) oder Dampf (gasförmiger Zustand) werden kann.
Der Unterschied zwischen der Flüssigkeit und den gasförmigen Zuständen liegt auf der molekularen Ebene, dh aufgrund unterschiedlicher Merkmale der Moleküle, aus denen sie bestehen. Jede Flüssigkeit besteht aus winzigen Partikeln, die in oder in unmittelbarer Nähe zu ihren ursprünglichen Positionen vibrieren. Die Partikel werden durch intermolekulare Kräfte zusammengehalten. Eine bestimmte Masse einer Flüssigkeit hat ein festes Volumen, dh die Region wird eingesetzt, bleibt festgelegt. Wenn Sie eine Flüssigkeit in einen Behälter gießen, besetzt die Flüssigkeit einen Bereich, der ihrem Volumen entspricht. Dies gilt nicht für Materie im gasösen Zustand. Die winzigen Partikel, aus denen sich jedes Gas zusammensetzt. Sie können sich zufällig überall bewegen und die Anziehungskräfte zwischen diesen Partikeln sind sehr niedrig. Sie sind weniger als die Kräfte in einer Flüssigkeit und daher wird die Bewegung eines Gases als Zufallsbewegung bezeichnet, während die Bewegung einer Flüssigkeit als fließende Bewegung bezeichnet wird. Darüber hinaus ist das Volumen eines Gases nicht im Gegensatz zu einer Flüssigkeit festgelegt. Da die Partikel in einer zufälligen Bewegung sind, können sie sich überall hinweg bewegen, wo sie können. Daher nimmt das Gas das Volumen des Behälters an. Dies bedeutet, dass ein Gas in einem Behälter das gleiche Volumen wie das des Behälters hat. Die Partikel werden sich ausbreiten und so viel Region wie möglich besetzen. Wenn die gleiche Menge Gas in einen größeren Behälter verschoben wird, besetzen die Gaspartikel ein größeres Volumen. Das Volumen hat daher zugenommen. Daher kann man mit Sicherheit sagen, dass das Volumen eines Gases nicht festgelegt ist.
Aufgrund schwächerer Anziehungskräfte haben die Partikel große Räume zwischen ihnen im gasförmigen Zustand. Im Gegensatz dazu haben die Partikel in einer Flüssigkeit einen relativ niedrigeren Raum zwischen ihnen. Dies ist auch der Grund für das feste Volumen einer Flüssigkeit im Gegensatz zu einem Gas.
Die Energie der Partikel ist ein weiterer Bereich, in dem ein Gas und eine Flüssigkeit unterschiedlich sind. Die Energie der Partikel bestimmt auch die Räume zwischen ihnen und damit den Zustand der Materie. Die Teilchen eines Gases haben die größte Energie der drei Grundzustände. Daher zeigen die Partikel eine große Bewegung und verbreiten sich daher so viel wie möglich. Die Partikel einer Flüssigkeit haben jedoch eine geringere Energie als die eines Gases. Daher bleiben sie normalerweise in unmittelbarer Nähe ihrer Anfangspositionen, solange andere Bedingungen gleich bleiben.
Zusammenfassung der in Punkten ausgedrückten Unterschiede
- Eine Flüssigkeit besteht aus winzigen Partikeln, die in oder in unmittelbarer Nähe ihrer ursprünglichen Positionen vibrieren; Ein Gas besteht aus Partikeln, die sich frei bewegen können, wo sie sich überall hinweg bewegen können
- Die Bewegung eines Gases ist zufällig; Die Bewegung einer Flüssigkeit wird als Fluss bezeichnet
- In Flüssigkeiten gibt es stärkere intermolekulare Anziehungskräfte als Gase
- Es gibt einen stärkeren Abstand zwischen den Partikeln eines Gases als denen einer Flüssigkeit
- Die Teilchen eines Gases haben eine größere Energie als die einer Flüssigkeit
- Die oben genannten Gründe berücksichtigen das feste Volumen einer Flüssigkeit, das Volumen eines nicht festgelegten Gass und gleich dem Volumen des Behälters, in dem es sich befindet


