Unterschied zwischen starker und schwacher Säure
- 1285
- 271
- Cem Schlitzer
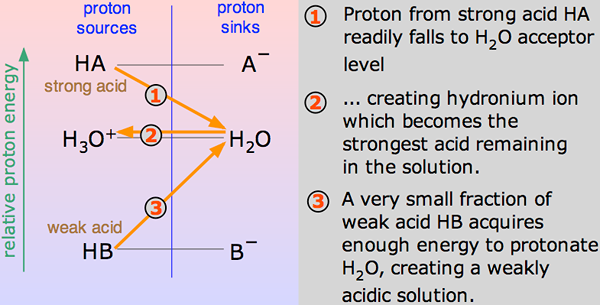
Säuren sind chemische Substanzen, die Wasserstoffionen oder Protonen spenden, wenn sie in Lösungen gemischt werden. Die Anzahl der von einer bestimmten Säure abgegebenen Protonen bestimmt tatsächlich die Stärke der Säure - ob es sich um eine starke Säure oder eine schwache Säure handelt. Um die Stärke der Säuren zu verstehen, muss man ihre Tendenz, Protonen mit der ähnlichen Basis (hauptsächlich Wasser) zu spenden, vergleichen, um Protonen zu spenden. Die Stärke wird durch eine Zahl namens PKA bezeichnet.

Was ist eine starke Säure?
Eine Säure soll stark sein, wenn sie in einer Lösung vollständig dissoziiert oder ionisiert. Das heißt, es ist in der Lage, die größte Anzahl von H+ -Ionen oder Protonen zu geben, wenn sie in einer Lösung gemischt werden. Diese Ionen sind die geladenen Partikel. Da eine starke Säure eine größere Anzahl von Ionen spendet, wenn sie zusammenbricht oder ionisiert, bedeutet dies, dass eine starke Säure ein Leiter von Elektrizität ist.
Wenn sich eine Säure in h mischt2O, ein Proton (h+ Ion) wird zu einem h getragen2O Molekül, um einen H3O zu erzeugen+ (Hydroxoniumion) und ein Ion basierend darauf, mit welcher Säure zunächst mit Säure beteiligt ist.
In einem allgemeinen Szenario,
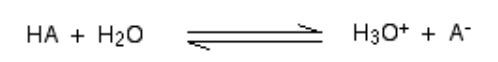
Solche chemischen Reaktionen können verehrt werden, aber in wenigen Fällen wird die Säure verschenkt H+ Ion ist ganz leicht und die Reaktion sieht aus, als wäre er Einwegsweg. Und die Säure ist vollständig dissoziiert.
Für e.G., Wenn sich Wasserstoffchlorid in h auflöst2O Um HCl zu machen, so wenig von der umgekehrten Reaktion, dass wir schreiben können:

Zu einer Zeit findet eine virtuelle hundertprozentige virtuelle Reaktion statt, wobei Wasserstoffchlorid mit H3O Reaktion aufweist+ (Hydroxoniumion) und CL- Ionen. Hier ist die starke Säure Wasserstoffchlorid.
Was ist eine schwache Säure?
Eine Säure soll schwach sein, wenn sie teilweise oder unvollständig ionisiert und nur einige seiner Wasserstoffatome in die Lösung eingibt. Daher ist es im Vergleich zu einer starken Säure beim Abgeben von Protonen weniger fähig. Schwache Säuren haben höhere PKA als starke Säuren.
Ethansäure ist ein gutes Beispiel für eine schwache Säure. Es zeigt Reaktion mit H2O für die Herstellung von H3O+ (Hydroxoniumionen) und CH3COOH (Ethanoationen), aber die umgekehrte Reaktion zeigt mehr Erfolg als die vorwärts. Die Moleküle reagieren sehr leicht, um die Säure und die H zu verbessern2Ö.

Zu jeder Zeit nur etwa ein Prozent des CH3COOH -Säuremoleküle zeigen Umwandlung in Ionen. Was auch immer übrig bleibt, ist die einfache Essigsäure (systematisch als Ethansäure bezeichnet) Moleküle.
Unterschied zwischen starker Säure und schwacher Säure
-
Definition
Starke Säure
Eine starke Säure ist eine Säure, die in einer wässrigen Lösung vollständig ionisiert. Eine starke Säure verliert immer ein Proton (A H+), wenn er in H gelöst wird2Ö. Mit anderen Worten, eine starke Säure befindet sich immer auf den Zehen und ist ziemlich effizient, um Protonen abzugeben.
Schwache Säure
Eine schwache Säure ionisiert teilweise in einer Lösung. Es gibt nur wenige seiner Wasserstoffatome in die Lösung ab. Daher ist es weniger fähig als eine starke Säure.
-
Elektrische Leitfähigkeit
Starke Säure
Starke Säuren zeigen immer eine starke Leitfähigkeit. Starke Säuren passieren normalerweise mehr Strom im Vergleich zu den schwachen Säuren für die gleiche Spannung und Konzentration.
Schwache Säure
Schwache Säuren haben eine geringe Leitfähigkeit. Sie sind arme Leiter und zeigen einen niedrigen Wert für den aktuellen Pass
-
Reaktionsrate
Starke Säure
Die Reaktionsgeschwindigkeit ist in den starken Säuren schneller
Schwache Säure
Die Reaktionsgeschwindigkeit ist in schwachen Säuren langsamer
-
Beispiele
Starke Säure
Salzsäure (HCl), Salpetersäure (HNO3) Perchlorsäure (HCLO4), Schwefelsäure (h)2SO4), Hydroiodsäure (HI), Hydrobromensäure (HBR), Chlorsäure (HCLO3).
Schwache Säure
Schwefelsäure (h2SO3), Essigsäure (CH3COOH), Phosphorsäure (H)3Po4), Benzoesäure (C6H5COOH), Hydrofluorsäure (HF), Ameisensäure (HCOOH), Lachsäure (HNO2).
-
pH
Starke Säure
In einer starken Säure ist der pH -Wert niedriger als, im Allgemeinen 3. Starke Säuren besitzen eine sehr hohe Konzentration von H+ -Ionen (eine Säure mit einem pH -Wert von 3 hat 0.001 Mol pro Liter Wasserstoffionen).
Schwache Säure
Eine schwache Säure hat einen pH-Wert zwischen 3-7.
-
Wert von PKA
Starke Säure
In einer starken Säure ist der Wert von PKA ziemlich niedrig.
Schwache Säure
In einer schwachen Säure ist der Wert von PKA ziemlich hoch.
-
Dissoziation
Starke Säure
HCl (g)+H2O (l) ≈ H3Ö+(aq)+cl-(aq)
Schwache Säure
CH3Cooh (l)+h2o (l) ≈ h3Ö+(aq)+ch3GURREN-(aq)
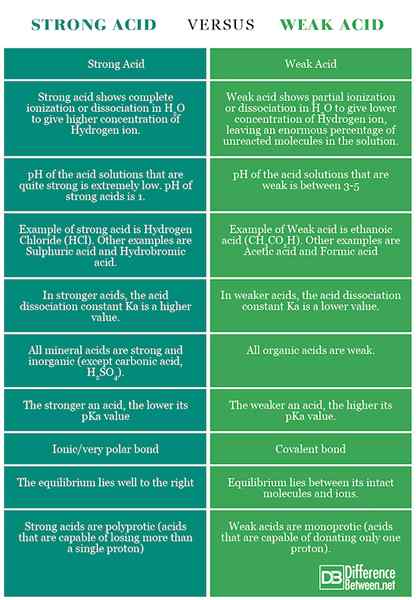
Zusammenfassung starker Säure vs. Schwache Säure
Die Unterschiede zwischen starken und schwachen Säuren wurden im Folgenden zusammengefasst: Vergleichstabelle
- « Unterschied zwischen spezifischer Wärme und Wärmekapazität
- Unterschied zwischen Herren- und Frauengolfclubs »

