Unterschied zwischen Sigma und PI -Bindung
- 2380
- 720
- Caitlin Rodehau
Was ist Sigma Bond?
Sigma -Bindungen sind Bindungen zwischen Atomen in Molekülen, die entlang der Achse gebildet werden, die die gebundenen Kerne der Atome verbinden.
Molekulare Bindungen
Moleküle bilden sich, wenn sich Atome durch chemische Bindung tauschen oder teilen. Es gibt im Wesentlichen drei Arten von Bindungen. Ionenbindungen, metallische Bindungen und kovalente Bindungen. In ionischen Bindungen tauschen die Atome einfach ein Elektron aus, damit ein Atom positiv geladen wird und das andere negativ geladen wird, was dazu führt, dass sie sich von der elektromagnetischen Kraft anziehen. In metallischen Bindungen werden Elektronen gleichmäßig über das gesamte Molekül verteilt, das ein Meer freier, delokalisierter Elektronen erzeugt, die positiv geladene Ionen umhüllt, die von den Elektronen angezogen werden.
Innerhalb kovalenter Bindungen werden die Elektronen geteilt und die Art und Weise, wie sie geteilt werden.
Orbitale und Sigma -Anleihen
Orbitale sind Regionen um Atome, die mit bestimmten Energieniveaus verbunden sind. Elektronen in Orbitalen weiter vom Kern haben mehr Energie als Elektronen in Orbitalen näher am Kern. Wenn sich die Orbitale eines Atoms mit den Orbitalen eines anderen Atoms überlappen, bilden sie molekulare Orbitale, die molekulare Bindungen ermöglichen, die natürlich Moleküle ermöglichen.
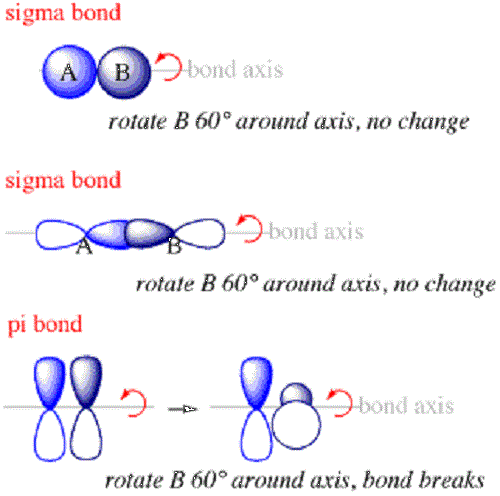
Sigma -Bindungen sind die erste Art von Bindung, die zwischen Atomen bildet. Innerhalb einer Sigma -Bindung befinden sich die Wolken der Elektronenwahrscheinlichkeit entlang der Achse, die die Kerne der gebundenen Atome verbinden. Sigma -Bindungen bilden sich normalerweise, wenn S Orbitale aus verschiedenen Atomen überschneiden sich, um eine Bindung zu erstellen. Sie werden sich immer entlang der Achse zwischen den beiden Kernen bilden, weil die S Orbital ist in einer Kugel um den Kern angeordnet.
Sigma -Anleihen und Sigma -Orbitale
Die Elektronen, die die Sigma -Bindung ausmachen. Die Sigma-Anleihe kann jedoch stabil oder instabil sein.
Die Sigma-Bindungsorbitale befinden sich im Raum zwischen den Kernen, während sich anti-dichtende Orbitale entlang der Achse befinden, die die Kerne verbinden, jedoch an den Seiten der Atome gegenüber dem Raum zwischen ihnen. Die Sigma -Bindung ist stabil, wenn sich mehr Elektronen in den Bindungsorbitalen befinden und instabil sind, wenn sich mehr in den Antibindungsorbitalen befinden oder wenn es eine gleiche Anzahl von Elektronen in beiden gibt.

Was ist PI Bond?
PI -Bindungen sind Bindungen zwischen Atomen innerhalb von Molekülen, in denen sich die Elektronen über und unter der Achse befinden, die die Kerne der verbundenen Atome verbinden, jedoch nicht entlang der Achse. Sie sind die zweite Art von Bindung, die sich innerhalb eines Moleküls nach der Sigma -Bindung bildet.
Pi Bindungen und P Orbitale
Der Grund, warum sich PI -Bindungen über und unter der Bindungsachse bilden P Orbitale an den gebundenen Atomen. Diese Orbitale haben keine Elektronendichte am Kern. Infolgedessen bilden die Elektronen die PI -Bindungen, die sich aus der Überlappung bilden P Orbitale gruppieren sich immer in einer Region, die nicht direkt neben dem Kern liegt. PI -Bindungen können sich auch zwischen anderen atomaren Orbitalen bilden, wie z D Orbitale mit gemeinsamen Merkmale mit P Orbitale.
PI -Anleihen und PI -Orbitale
Wenn P Orbitale verschiedener Atome überlappen sich, sie erzeugen molekulare PI -Orbitale, die es PI -Bindungen bilden lassen. Die Bindung kann je nach Orbital, in dem sich das Elektron befindet, wieder stabil oder instabil sein. Die PI -Anleihe ist stabil, wenn sich mehr Elektronen in den PI -Bindungsorbitalen befinden. Es wird instabil sein, wenn sich mehr in den Anti-Bindungsorbitalen befinden oder wenn sich eine gleiche Zahl in beiden befindet.
Ähnlichkeiten zwischen Sigma -Bindungen und PI -Bindungen
Sigma -Bindungen und PI -Bindungen basieren beide auf spezifischen molekularen Orbitalen, die beispielsweise aus der Überlappung bestimmter atomarer Orbitale abgeleitet werden, S Orbitale im Fall von Sigma -Anleihen und P Orbitale im Fall von PI -Anleihen. Sie können auch stabil oder instabil sein, je nachdem, ob sich die Elektronen in den molekularen Orbitalen der Bindungsmolekül oder in Anti-Bindungsmolekular-Orbitalen befinden.
Unterschiede zwischen Sigma -Bindungen und PI -Bindungen
Trotz ihrer Ähnlichkeiten gibt es wichtige Unterschiede.
- Elektronen, die Sigma -Bindungen ausbauen, werden im Raum entlang der Achse verteilt, die die verbundenen Kerne verbinden.
- Sigma -Bindungen sind die ersten Bindungen, die zwischen Atomen innerhalb von Molekülen bilden, während PI -Bindungen die zweiten sind.
- Sigma -Bindungen werden häufig durch die Kombination von gebildet S Orbitale in verschiedenen Atomen, während PI -Bindungen aus der Kombination von gebildet werden P und ähnliche Orbitale in verschiedenen Atomen.
- Darüber hinaus ist die Ausrichtung überlappender Orbitale, die PI -Bindungen bilden.
Sigma Bonds vs. PI -Bindungen
| Sigma Bond | PI Bond |
| Atom -Orbitale überlappen sich entlang der Bindungsachse | Atom -Orbitale überlappen sich über und unterhalb der Bindungsachse |
| Erste Bindungen, die zwischen Atomen innerhalb von Molekülen bilden, | Zweite Bindungen zwischen Atomen innerhalb von Molekülen zu bilden |
| Gebildet aus überlappenden Orbitalen wie z S Orbitale | Gebildet aus überlappenden Orbitalen wie z P Orbitale |
| Überlappende Orbitale senkrecht zu denen von PI -Anleihen | Überlappende Orbitale senkrecht zu denen von Sigma -Anleihen |
Zusammenfassung: Sigma und PI -Bindungen
Die Sigma -Bindung ist eine Bindung zwischen Atomen innerhalb eines Moleküls, das häufig von gebildet wird S Orbitale überlappen sich entlang der Achse, die die angeschlossenen Kerne verbinden. Es ist die erste, die sich bild. PI -Bindungen sind molekulare Bindungen, die häufig durch Überlappung gebildet werden P Orbitale aus verschiedenen Atomen. Die Elektronen, die PI -Bindungen ausmachen. Die Stabilität dieser Bindungen hängt auch von den PI -Orbitalen der Bindung und der Antibunden ab. Sigma -Bindungen werden die ersten Bindungen sein, die sich innerhalb von Molekülen bilden, während PI -Bindungen die zweiten Bindungen sind, die sich formen, um sich zu formen. PI -Bindungen bilden sich auch aus Atomorbitalen, die senkrecht zu denjenigen ausgerichtet sind, die Sigma -Bindungen ausmachen.

