Unterschied zwischen Perioden und Gruppen
- 3785
- 375
- Ines Plank
Perioden und Gruppen sind die beiden wichtigen Klassifikationen, mit denen alte Chemiker die ikonische Periodenabteilung in Säulen und Zeilen organisierten. Perioden sind die horizontalen Zeilen, während die Gruppen, auch Familien, die vertikalen Spalten sind. Die Elemente wurden in Gruppen und Perioden angeordnet, die auf bestimmten Merkmalen wie chemischen/physikalischen Eigenschaften für Gruppen und Elektronenkonfigurationen für die Zeiträume basieren. Der Artikel entfaltet weitere Unterschiede zwischen den Perioden und Gruppen.

Was sind Perioden?
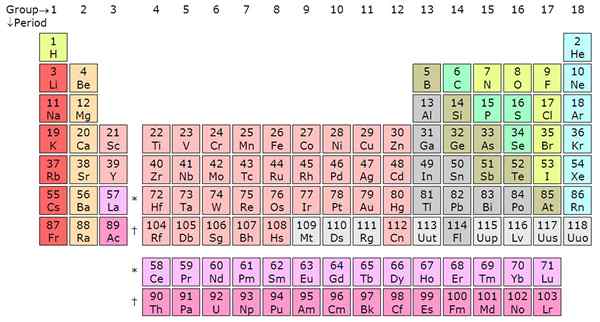
Zählen Sie von links rechts rechts auf dem Periodenzüchter, es ist der Zeitraum. Es gibt typischerweise 7 Perioden in einer Periodenzüchttabelle und jede Periode bezeichnet eine neue Energieschale. Von Wasserstoff bis Francium in Periode 7 erhöhen die Elemente die Atomorbitale. Dies bedeutet.
Lithium (LI) hat zum Beispiel zwei Energieschalen, da es in Periode 2 ist, während Kalium (k) vier Energieschalen hat, da es in Periode 4 ist. Dieser Trend gilt für alle anderen Elemente. Innerhalb eines bestimmten Zeitraums teilen sich die Elemente die äußeren Schalenelektronen (Valenz). Zum Beispiel sind Wasserstoff und Helium in derselben Gruppe und haben ein Elektron in der Außenhülle. Beachten Sie, dass die erste Periode nur zwei Elemente hat. Die zweite und die dritten Perioden haben jeweils 8 Elemente.
Perioden 4 und 5 haben jeweils 18 Elemente. In der Periodenzüchter hat insgesamt 18 Gruppen gemäß dem IUPAC -Namenssystem. Perioden 6 und 7 sind die Ausnahmen, da sie insgesamt 32 Elemente enthalten. Dies erläutert, warum die Periodenzüchter durch die Entfernung von Zeitraum 6 und 7 verkürzt und direkt unterhalb der Periodenzüchter angezeigt wird. Die Periodenschaft wäre groß, wenn die Actinides und Lanthanide nicht entfernt würden. Diese getrennten Elemente sind innere Übergangsmetalle und füllen den F-Block in den Atomorbitalen. Die Lanthanide umfassen die Elemente von 58 bis 71, während die Actinides die Elemente von 89 bis 103 enthalten.
Das andere Merkmal, dass die Elemente innerhalb eines Zeitraums eine Erhöhung der Ionisationsenergie sind. Atome innerhalb eines Zeitraums der Atomzahlen, wenn mehr Protonen zunehmend zugesetzt werden. Dies erhöht die Anziehungskraft im Kern und es wird relativ schwierig, ein Elektron zu entfernen. Die Nuklearladung steigt über den Periodengangstabelle. Außerdem steigt die Elektronegativität, wenn Sie sich über den Zeitraum von links nach rechts bewegen. Die Elektronenaffinität nimmt auch zu, wenn mehr Elektronen zugegeben werden, wodurch eine starke Anziehungskraft mit dem Kern erhöht wird.
Was sind Gruppen?
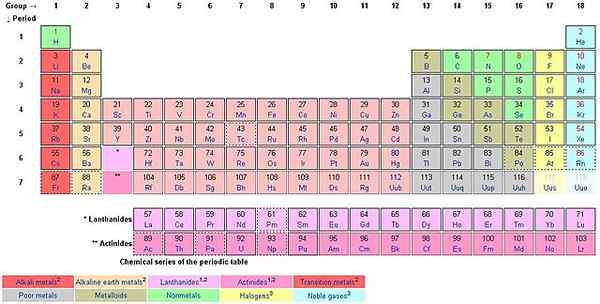
Wenn Sie sich von oben nach unten entlang der Spalten zählen, zählen Sie die Gruppen. Der europäische Namensstil ꟷ wird jetzt als IUPAC -Namensstil übernommen, um die Gruppen von 1 bis 18 zu benennen. Der US -Stil verwendet AS und BS.
Jede der 18 Gruppen trägt einen Namen. Zum Beispiel ist die erste Gruppe als Lithiumfamilie (Alkali -Metalle), Gruppe 2 The Beryllium Family (Alkaline Earth Metals, Gruppe 3 The Scandium Family, Gruppe 4 The Titanium Family, Gruppe 5 Die Familie Vanadium, Gruppe 6 Die Chromiumfamilie, bekannt , Gruppe 7 der Manganfamilie, Gruppe 8 Die Iron -Familie, Gruppe 9 The Cobalt Family, Gruppe 10 Die Nickel -Familie, Gruppe 11 Die Kupferfamilie (Coinage Metals), Gruppe 12 Die Zinkfamilie (Volatile Metals), Gruppe 13 Die Familie Boron (ICOASAGENS), Gruppe 14 Kohlenstofffamilie (Kristallogene, Tetrelle), Gruppe 15 Die Stickstofffamilie (Pentels), Gruppe 16 Die Sauerstofffamilie (Chalcogene), Gruppe 17 Die Fluorfamilie (Halogene) und Gruppe 18 der Helium- oder Neonfamilie (Familie Neon -Familie (Familie Edelgase).
Die Elemente innerhalb einer Gruppe teilen chemische oder physikalische Eigenschaften. Gruppe 18 zum Beispiel wird als edle Gase bezeichnet. Sie sind nicht reaktiv mit anderen Elementen. Die Oktettregel von 8 Elektronen in der Außenhülle gilt perfekt für die edlen Gase. Alle anderen Elemente bemühen sich, die Oktettregel zu erreichen. Wasserstoff folgt nicht der Oktettregel, ebenso wie Helium, obwohl es stabil ist und ein Teil der edlen Gase ist.
Periodentabelle hat eine Mischung aus Metallen, Nichtmetallen und Metalloiden (Semimetalen). Es gibt bestimmte Gruppierungselemente nach ihren ähnlichen Eigenschaften, und darunter Alkali -Metalle, alkalische Erdmetalle, Übergangsmetalle (Lanthanide, Seltene Erdmetalle und Actinide), Nichtmetalle, Metalloide, Edelgase, Halogene und Basismetalle.
Es gibt auch einen Trend, Immobilien zu erhöhen, wenn Sie in der Gruppe oder in der Gruppe stehen. Während Sie nach oben gehen. Wenn Sie die Gruppe hinuntergehen. Der elektronegative nimmt ebenfalls ab, wenn Sie die Gruppe hinuntergehen, da die Energieniveaus in der Gruppe steigen. Die Elektronen in der Außenhülle sind in der Regel weit vom Kern entfernt und so nimmt der Pool ab.
Schlüsselunterschiede zwischen Perioden und Gruppen
Ort auf dem Periodenzüchter
Perioden sind horizontale Zeilen, während die Gruppen die vertikalen Säulen auf der Periodenzüchter sind. Es gibt 7 Perioden und 18 Gruppen. Periode 6 und 7 haben 32 Elemente aufgrund der Zugabe der Actinides und Lanthanides.
Merkmale definieren
Elemente in einer Gruppe haben ähnliche chemische oder physikalische Eigenschaften. Sie haben die gleiche Anzahl von Valenzelektronen. Auf der anderen Seite teilen sich Elemente im gleichen Zeitraum dieselbe Elektronenkonfiguration.
Elektronegativität
Der elektronegative Abnehmen abnimmt, wenn Sie die Gruppe hinuntergehen, und erhöht sich, wenn Sie aufgrund eines erhöhten Zuges im Kern aufgrund weniger Energieniveaus steigen. Die Elektronegativität nimmt zu, wenn Sie über den Zeitraum von links nach rechts gehen, wobei mehr Protonen mit zunehmender Atomzahlen ansteigt.
Perioden vs. Gruppen: tabellarische Form

Zusammenfassung der Perioden vs. Gruppen
- Periodenzüchter ist in Perioden und Gruppen eingerichtet
- Gruppen sind vertikale Spalten, während Perioden die horizontalen Zeilen sind
- Elemente in einer Gruppe teilen chemische oder physikalische Eigenschaften, während Elemente in einem Zeitraum die gleichen Elektronenkonfigurationen haben
- Es gibt 7 Perioden und 18 Gruppen auf dem Periodenzüchttisch
- Die Elektronegativität steigt innerhalb des Zeitraums von links nach rechts und innerhalb der Gruppe von unten nach oben

