Unterschied zwischen Teildruck und Dampfdruck
- 3182
- 260
- Tina Gürbig
Teildruck und Dampfdruck werden üblicherweise wissenschaftliche Begriffe in Bezug auf die Menge des Drucks von Systemkomponenten verwendet, aber ihre Identität kann für andere verwirrend sein. Es gibt eine klare Unterscheidung zwischen diesen Begriffen, einschließlich ihrer Auswirkungen und ihrer Identität. Dieser Artikel wird mehr über die Unterschiede zwischen diesen Begriffen eingehen. Es wird auch einige Beispiele enthalten, um die Anwendungen davon zu entmystifizieren.
Beginnen wir damit, das Druckkonzept hervorzuheben, bevor wir uns mit der Unterscheidung zwischen Dampf und Teildruck befassen können. Druck wird wissenschaftlich definiert als die pro Bereich auf einem Objekt oder eine Substanz angewendete Kraft. Es kann auch als die Kraft definiert werden, die von den kollidierenden Partikeln aufeinander angewendet wird und häufig mit Pascal gemessen wird. Bei Kollision von Partikeln wird die Gasgleichung und die kinetische Theorie von Gasen verwendet, um den Druck zu berechnen.

Was ist Dampfdruck?
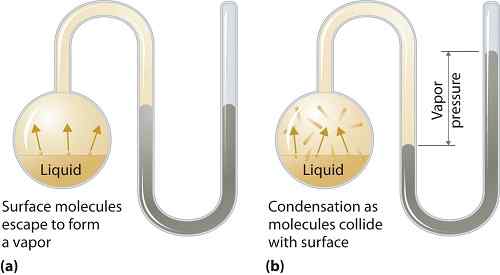
Dampfdruck kann auf flüssige oder feste Phasen ausgewiesen werden. Es ist der Druck, den der Dampf in seinem thermodynamischen Gleichgewicht auf seinem flüssigen oder festen Zustand bei einer bestimmten Temperatur in einem geschlossenen System ausübt, wenn sowohl der Dampf als auch die Flüssigkeit (fest) in Kontakt sind. Dieser Druck ergibt sich aus der Verdampfung, die durch eine erhöhte Wärme des Feststoffs oder der Flüssigkeit ermöglicht wird. Somit wird die Temperatur als Maß für die Verdampfung verwendet und ist direkt proportional zum Dampfdruck. Je höher die Temperatur ist, desto höher ist der Dampfdruck.
Während der Verdampfung entkommen die Luftmoleküle infolge der höheren kinetischen Energie zur Luft in einem geschlossenen System. Im Gleichgewicht tritt der Dampfdruck zwischen dem Dampf und seiner kondensierten Form von Flüssigkeit (fest) auf. In Lösungen, bei denen die intermolekularen Kräfte schwächer sind, ist der Dampfdruck in der Regel mehr, und umgekehrt in Lösungen, in denen die intermolekularen Kräfte stärker sind, ist der Dampfdruck geringer.
Der Dampfdruck kann auch in idealen Gemischen auftreten, wie das Raoult -Gesetz erklärt wird. Es gibt an, dass der partielle Dampfdruck einer bestimmten Komponente in einem flüssigen oder festen Gemisch dem Dampfdruck dieser Komponente gleich multipliziert wird, die mit einer bestimmten Temperatur multipliziert werden. Das folgende Beispiel veranschaulicht das.
Beispiel 1.
Gegeben eine ideale Mischung von 0.5 mol. Ethanol und 1.5 mol. Methanol mit dem Dampfdruck von 30 kPa bzw. 52 kPa bestimmen den partiellen Dampfdruck jeder Komponente.
Lösung:
Die Gesamtzahl der Maulwürfe beträgt 1.5mol + 0.5mol = 2.0mol. Nach dem Gesetz von Raoult entspricht der partielle Dampfdruck dem Dampfdruck multipliziert mit dem Molfraktion dieser bestimmten Komponente. In diesem Fall das pMethanol = 1.5/2 * 52 = 39 kPa und pEthanol = 0.5/2 * 30 = 7.5kpa.
Wenn Sie den partiellen Dampfdruck der Komponenten in der Mischung haben, können Sie den gesamten Dampfdruck erhalten, indem Sie sie zusammen hinzufügen. In dieser Hinsicht 7.5 + 39 gibt 46.5 kPa Gesamtdampfdruck des Gemisches aus Ethanol- und Methanol -Lösungen.
Faktoren, die den Dampfdruck beeinflussen
Moleküleidentität
Wie bereits oben erwähnt, bestimmen die Arten von molekularen Kräften die Menge des zu ausgeübten Dampfdrucks. Wenn die Kräfte stärker sind, entsteht weniger Dampfdruck, und wenn schwächer, entsteht mehr Dampfdruck. Daher beeinflusst die Zusammensetzung der Flüssigkeit oder des Feststoffs den Dampfdruck.
Temperatur
Eine höhere Temperatur führt zu einem höheren Dampfdruck, da er mehr kinetische Energie aktiviert, um die molekularen Kräfte zu brechen, sodass die Moleküle schnell der flüssigen Oberfläche entkommen können. Wenn der Dampfdruck (gesättigter Dampfdruck) entspricht dem äußeren Druck (Atmosphärendruck), beginnt die Flüssigkeit zu kochen. Eine niedrigere Temperatur führt zu einem niedrigen Dampfdruck und dauert Zeit, bis die Flüssigkeit kochen kann.

Daltons Gesetz des Teildrucks
Was ist Teildruck?
Die Idee des Teildrucks wurde erstmals vom renommierten Wissenschaftler John Dalton vorgeschlagen. Es brachte sein Gesetz des teilweisen Drucks hervor, der besagt. Angenommen, ein bestimmter Behälter ist mit Wasserstoff, Stickstoff und Sauerstoffgasen, dem Gesamtdruck, p gefüllt, PGESAMT, ist gleich der Summe von Sauerstoff, Stickstoff und Wasserstoff. Der Teildruck eines Gases in dieser Misch.
Kurz gesagt, Teildruck ist der Druck, der durch ein bestimmtes Gas im Gemisch ausgeübt wird, als würde er allein im System wirken. So ignorieren Sie andere Gase, wenn Sie den Teildruck eines einzelnen Gases bestimmen. Diese Theorie kann durch Injektion von 0 überprüft werden.6atm von o2 in einem 10.0 l Behälter bei einem 230k und dann 0 injizieren 0.4atm n2 in einem identischen Behälter mit derselben Größe bei gleicher Temperatur und dann letztendlich die Gase kombinieren, um den Gesamtdruck zu messen; Es wird die Summe der beiden Gase sein. Dies erklärt deutlich den Teildruck eines einzelnen Gases in einer Mischung aus nicht reaktiven Gasen.
Berechnung des Teildrucks
Die Berechnung des Teildrucks ist eine absolute Brise, da das Daltonsche Gesetz [1] Bestimmungen dafür vorlegt. Es hängt von den typischen Informationen ab. Wenn beispielsweise der Gesamtdruck für ein Gemisch aus Gas A und B sowie der Druck von Gas A angegeben ist, kann der Teildruck von B durch Verwendung von P berechnet werdenGESAMT = PA + PB. Der Rest sind algebraische Manipulationen. In einem Fall, in dem nur der Gesamtdruck des Gemisches gegeben wurde. Die durch x gekennzeichnete molare Fraktion kann durch Teilen der Gasmolmolmolmes durch die gesamten Mol des Gasgemisches gefunden werden. Um den Teildruck zu finden, multiplizieren Sie die Molfraktion x mit dem Gesamtdruck. Das folgende Beispiel erläutert das.
Beispiel 2.
Eine Mischung aus Stickstoff und Sauerstoff mit 2.5 Maulwürfe und 1.85 Maulwürfe werden jeweils in eine 20 injiziert.0L -Behälter mit einem Gesamtdruck von 4ATM; Berechnen Sie den vom Sauerstoffgas ausgeübten Teildruck.
Lösung:
Die Gesamtzahl der Maulwürfe in der Mischung beträgt 2.5 + 1.85 = 4.35 Maulwürfe. Also der Molfraktion von Sauerstoff, xÖ, wird 1 sein.85 Maulwürfe/4.35 Moles = 0.425 Maulwürfe. Der Teildruck von Sauerstoff beträgt 0.425 * 4ATM = 1.7atm. Der Teildruck des verbleibenden Gases kann nach demselben Ansatz berechnet werden oder durch Verwendung des Sauerstoffgases und des Gesamtdrucks berechnet werden Der Teildruck.
Unterschied zwischen Dampf und Teildruck
Aus den obigen Erklärungen ist es offensichtlich, dass Dampfdruck und Teildruck zwei unterschiedliche Drücke sind. Der Dampfdruck gilt für flüssige und feste Phasen, während der Teildruck für die gasförmige Phase gilt. Der Dampfdruck wird im Phasenübergang ausgeübt, nachdem der Lösung ausreichend Wärme zugesetzt wurde.
Der Hauptunterschied zwischen Teildruck und Dampfdruck besteht darin, dass Teildruck der Druck ist, der durch ein einzelnes Gas in einem Gemisch ausübt sein kondensierter Zustand von flüssigem oder festem Zustand. Die folgende Tabelle ergibt einen präzisen Vergleich dieser Drucke.
| Dampfdruck | Partialdruck |
| Es wird durch flüssige oder feste Dampf in seiner kondensierten Phase im Gleichgewicht ausgeübt | Es wird durch einzelne Gase in einem nicht reaktiven Gasgemisch ausgeübt |
| Gut erklärt durch Raoultes Gesetz | Gut erklärt durch Daltons Gesetz |
| In festen und flüssigen Phasen anwendbar | Nur in gasförmigen Phasen anwendbar |
| Unabhängig von der Oberfläche oder dem Volumen des Systems | Berechnet unter Verwendung der Gase im gleichen Volumen |
| Berechnet unter Verwendung des Maulwurfsanteils des gelösten Stoffes | Berechnet unter Verwendung des Maulwurfsanteils des Gases |
Einpacken!
Dampfdruck und Teildruck sind zwei wichtige wissenschaftliche Begriffe, die bei der Bestimmung der Auswirkungen der vom Dampf und der Gase angewendeten Kräfte bei bestimmten Temperaturen in gegebenem geschlossenem System verwendet werden. Ihre Hauptdifferenz ist der Anwendungsbereich mit dem Dampfdruck auf flüssige oder feste Phasen, während der Teildruck auf ein einzelnes Gas in einem Gemisch von idealen Gasen in einem gegebenen Volumen ausgeübt wird.
Der Teildruck wird leicht berechnet, indem Sie dem Daltons Gesetz des Teildrucks folgen, während der Dampfdruck durch Anwendung des Raoult -Gesetzes berechnet wird. In einer bestimmten Mischung übt jede Gaskomponente ihren eigenen Druck aus, der als Teildruck unabhängig von anderen Gasen bezeichnet wird. Und wenn Sie die Mol jeder Komponente verdoppeln, wobei die Temperatur konstant bleibt, werden Sie ihren Teildruck erhöhen. Nach der Clausius-Clapeyron-Beziehung [2] steigt der Dampfdruck mit zunehmender Temperatur.
Mit den oben genannten Informationen sollten Sie in der Lage sein, zwischen Dampfdruck und Teildruck zu unterscheiden. Sie sollten auch in der Lage sein, sie unter Verwendung der Molfraktionen zu berechnen und mit dem Gesamtdruck zu multiplizieren. Wir haben Ihnen typische Beispiele gegeben, um die Anwendung dieser Drucke auszuarbeiten.

