Unterschied zwischen Nitrat und Nitrit
- 1913
- 263
- Caitlin Rodehau

Was ist Nitrat?
Das Nitration (nein3) ist eine konjugierte Basis der Salpetersäure. Es besteht aus einem Stickstoff und drei Sauerstoffatomen. Das Stickstoffatom befindet sich in der Mitte und wird von Sauerstoffatomen umgeben, die in einer planaren trigonalen Konformation identisch gebunden sind. Die Molmasse des Nitratanions beträgt 62 g/mol. Es dissoziiert in Wasser, um Nitrathydroxylionen zu verleihen.
Nitrate sind chemische Verbindungen, Salze der Salpetersäure. Sie sind leicht löslich. Die Nitrate werden verwendet in:
- Landwirtschaft (Mineraldünger);
- Lebensmittelindustrie (Farben und Konservierungsstoffe);
- Produktion von Farben, Medikamenten, Kunststoff, Glas, Sprengstoff usw.
Nitrate sind in Boden, Wasser und Nahrung (von Pflanzen- und tierischen Ursprungs) zu finden. Bei niedrigen Konzentrationen (1-40 mg/m3) Sie sind auch in der Luft als. Die Nitrate werden natürlich durch stickstoffhaltige Bakterien als Zwischenschritt bei der Bildung von Stickstoff synthetisiert. Die natürlichen Konzentrationen in Pflanzen und Wasser sind im Allgemeinen niedrig. Ihre Menge im Ackerland und in Wasser überschreitet normalerweise 10 mg/l nicht. Es kann durch den Einsatz von Stickstoffdünger, die Einführung des Viehdüngers und andere Quellen in den Boden erhöht werden.
Der Nitratgehalt der Pflanzen variiert abhängig von ihrer Menge im Boden. Aus der Bodenlösung extrahieren Pflanzen Stickstoff, Aminosäuren, Proteine, Vitamine und andere Substanzen, hauptsächlich in Form von Nitraten. Wenn die Pflanze mehr Nitrate extrahiert als die Enzymnitratreduktase, akkumulieren sie darin. Die Aktivität der Nitratreduktase hängt von Faktoren wie Licht, Temperatur und Wasserspannung ab.
Nitrate selbst sind nicht giftig. Gefahr für die menschliche Gesundheit sind die Nitriten und Nitrosamine. Beide können sich vor oder nach Einnahme von Nahrung oder Wasser aus den Nitraten bilden.
Nitrate betreten den menschlichen Körper über Nahrung und Trinkwasser. Lebensmittel, die reich an Nitraten sind, sind das Gemüse- und Fleischprodukt (Würste, geräuchertes Fleisch). Viel weniger vernachlässigbar ist der Nitratgehalt in Milchprodukten und Fisch. Einige Pflanzen haben die Fähigkeit, mehr Nitrate zu sammeln. Dies sind Salat, Karotten, Spinat, Dill, rote Rüben, rote Radieschen, Zucchini, Brokkoli usw.
Nitrate in der Luft können als Atemreizstoffe wirken. Studien haben eine Zunahme der asthmatischen Angriffe gezeigt, die mit einem erhöhten Nitratgehalt in der Luft verbunden sind.
Die maximal zulässige 24 -Stunden -Dosis Kalium und Natriumnitrat für Menschen beträgt bis zu 5 mg/kg. Die Vergiftung tritt in einer Dosis von 4 g/24 Stunden auf, die menschliche tödliche Dosis beträgt 8-15 g/24 Stunden.
Was ist Nitrit?
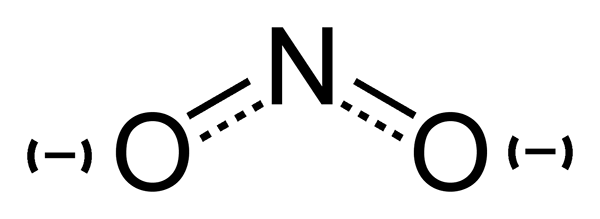
Das Nitrition (nein2) ist eine konjugierte Basis der Lessungssäure. Der Anion ist symmetrisch. Das Stickstoffatom befindet sich in der Mitte und wird von zwei Sauerstoffatomen umgeben, die identisch gebunden sind. Die Molmasse des Nitritanion beträgt 46 g/mol.
Nitriten sind chemische Verbindungen, Salze oder Ester der Lessrosensäure. Sie werden häufig bei der Herstellung von Fleisch- und Fischprodukten verwendet. Sie haben bakterizide Wirkung. Ihre Reaktion mit Myoglobin verleiht dem Fleisch einen frischen Look und eine rosa-rote Farbe.
Menschen können auf verschiedene Weise Nitraten ausgesetzt sein. Die übermäßige Stickstoffdüngung erhöht den Nitratgehalt in Pflanzen bzw. beim Menschen (über Lebensmittel). Im menschlichen Körper werden die Nitrate auf Nitriten reduziert. Die höheren Pflanzen können auch Nitrit aus dem Boden assimilieren. Die mikrobiologische Umwandlung von Nitraten in Nitriten kann auftreten, wenn frisches Gemüse gespeichert wird, insbesondere bei Raumtemperatur.
Bei der Einnahme werden Nitrate als „wahrscheinlich krebserregend für den Menschen“ eingestuft. Sie binden an das Hämoglobin im Blut und bilden eine Verbindung namens Methämoglobin. Es ist nicht in der Lage, Sauerstoff zu den Organen und Geweben zu tragen, was zu einer als Methämoglobinämie bekannten Erkrankung führt, die durch Blutergüsse der Haut und Schleimhäute gekennzeichnet ist (Cyanose).
Nitrate sind am gefährlichsten, wenn sie in Nitrit umgewandelt werden, bevor sie verschluckt werden. Diese Umwandlung kann auftreten, wenn das Essen nicht ordnungsgemäß (hohe Temperatur und verringerter Sauerstoffgehalt im Raum) oder beim Kochen gelagert wird, insbesondere beim Braten.
Nitriten schädigen die zellulären Strukturen verschiedener Organe und Systeme in Abhängigkeit von der Dosis direkt direkt. Sie stören den Transport von Sauerstoff, verursachen toxische Schäden an Enzymsystemen, verursachen mutagene, krebserzeugte und andere subzelluläre Veränderungen, verringern die Aktivität des Immunsystems.
Bei geringer Säure von Magensäure können Nitrite in Nitrosamine umgewandelt werden, die eine krebserregende Wirkung haben.
Die maximal zulässige Nitritdosis für 24 Stunden beträgt 0.2 mg/kg. Die menschliche tödliche Dosis beträgt 0.18-2.5 g/24 h. Es wird angenommen, dass 0 einnehmen.5 g Nitrit können zu mildem und 1-2 g zu schwerer Vergiftung führen.
Unterschied zwischen Nitrat und Nitrit
-
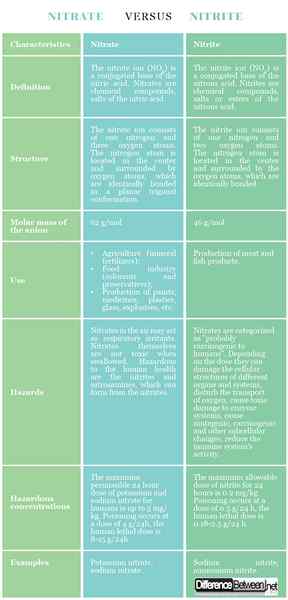
Definition
Nitrat: Das Nitration (nein3) ist eine konjugierte Basis der Salpetersäure. Nitrate sind chemische Verbindungen, Salze der Salpetersäure.
Nitrit: Das Nitrition (nein2) ist eine konjugierte Basis der Lessungssäure. Nitriten sind chemische Verbindungen, Salze oder Ester der Lessrosensäure.
-
Struktur
Nitrat: Das Nitration besteht aus einem Stickstoff und drei Sauerstoffatomen. Das Stickstoffatom befindet sich in der Mitte und wird von Sauerstoffatomen umgeben, die in einer planaren trigonalen Konformation identisch gebunden sind.
Nitrit: Das Nitrition besteht aus einem Stickstoff und zwei Sauerstoffatomen. Das Stickstoffatom befindet sich in der Mitte und wird von den Sauerstoffatomen umgeben, die identisch gebunden sind.
-
Molmasse
Nitrat: Die Molmasse des Nitratanions beträgt 62 g/mol.
Nitrit: Die Molmasse des Nitritanion beträgt 46 g/mol.
-
Verwenden
Nitrat: Die Nitrate werden in der Landwirtschaft (Mineraldünger), der Lebensmittelindustrie (Farben und Konservierungsstoffe), der Herstellung von Farben, Medikamenten, Kunststoffen, Glas, Sprengstoff usw. verwendet.
Nitrit: Die Nitriten werden zur Herstellung von Fleisch- und Fischprodukten verwendet.
-
Gefahren
Nitrat: Nitrate in der Luft können als Atemreizstoffe wirken. Nitrate selbst sind beim Schlucken nicht giftig. Gefahr für die menschliche Gesundheit sind die Nitriten und Nitrosamine, die sich aus den Nitraten bilden können.
Nitrit: Nitrate werden als „wahrscheinlich krebserregend für den Menschen“ eingestuft. Abhängig von der Dosis können sie die zellulären Strukturen verschiedener Organe und Systeme schädigen, den Transport von Sauerstoff stören, toxische Beschädigungen durch Enzymsysteme verursachen, mutagene, krebserregende und andere subzelluläre Veränderungen verursachen, die Aktivität des Immunsystems verringern.
-
Gefährliche Konzentrationen
Nitrat: Die maximal zulässige 24 -Stunden -Dosis Kalium und Natriumnitrat für Menschen beträgt bis zu 5 mg/kg. Die Vergiftung tritt in einer Dosis von 4 g/24 Stunden auf, die menschliche tödliche Dosis beträgt 8-15 g/24 Stunden.
Nitrit: Die maximal zulässige Nitritdosis für 24 Stunden beträgt 0.2 mg/kg. Die Vergiftung tritt in einer Dosis von 0 auf.5 g/24 h, die menschliche tödliche Dosis beträgt 0.18-2.5 g/24 h.
-
Beispiele
Nitrat: Kaliumnitrat, Natriumnitrat.
Nitrit: Natriumnitrit, Ammoniumnitrit.
Zusammenfassung:
- Das Nitration (nein3) ist eine konjugierte Basis der Salpetersäure. Nitrate sind chemische Verbindungen, Salze der Salpetersäure.
- Das Nitrition (nein2) ist eine konjugierte Basis der Lessungssäure. Nitriten sind chemische Verbindungen, Salze oder Ester der Lessrosensäure.
- Das Nitration besteht aus einem Stickstoff und drei Sauerstoffatomen. Das Stickstoffatom befindet sich in der Mitte und wird von Sauerstoffatomen umgeben, die in einer planaren trigonalen Konformation identisch gebunden sind. Das Nitrition besteht aus einem Stickstoff und zwei Sauerstoffatomen. Das Stickstoffatom befindet sich in der Mitte und wird von den Sauerstoffatomen umgeben, die identisch gebunden sind.
- Die Molmasse des Nitratanion beträgt 62 g/mol, während die Molmasse des Nitritanions 46 g/mol beträgt.
- Die Nitrate werden in der Landwirtschaft, in der Lebensmittelindustrie, in der Herstellung von Farben, Medikamenten, Kunststoffen, Glas, Sprengstoff usw. verwendet. Die Nitriten werden zur Herstellung von Fleisch- und Fischprodukten verwendet.
- Nitrate in der Luft können als Atemreizstoffe wirken. Nitrate selbst sind beim Schlucken nicht giftig. Gefahr für die menschliche Gesundheit sind die Nitriten und Nitrosamine, die sich aus den Nitraten bilden können. Nitrate werden als „wahrscheinlich krebserregend für den Menschen“ eingestuft. Abhängig von der Dosis können sie die zellulären Strukturen verschiedener Organe und Systeme schädigen, den Transport von Sauerstoff stören, toxische Beschädigungen durch Enzymsysteme verursachen, mutagene, krebserregende und andere subzelluläre Veränderungen verursachen, die Aktivität des Immunsystems verringern.
- Die maximal zulässige 24 -Stunden -Dosis Kalium und Natriumnitrat für Menschen beträgt bis zu 5 mg/kg. Die Vergiftung tritt in einer Dosis von 4 g/24 Stunden auf, die tödliche Dosis beträgt 8-15 g/24 Stunden. Die maximal zulässige Nitritdosis für 24 Stunden beträgt 0.2 mg/kg. Die Vergiftung tritt in einer Dosis von 0 auf.5 g/24 h, die tödliche Dosis beträgt 0.18-2.5 g/24 h.
- « Unterschied zwischen Christen und Muslimen
- Unterschied zwischen Temperatur und thermischer Energie »

