Unterschied zwischen Molmasse und molekularer Masse
- 1593
- 179
- Tina Gürbig
Chemiker messen Substanzen häufig unter Verwendung von Molmasse und Molekularmasse. Ein Beispiel wäre die Bestimmung der Anzahl der Moleküle in einem Zylinder. Chemie untersucht die Wechselwirkung von Atomen und Molekülen im atomaren Maßstab.

Was ist eine molekulare Masse?
Erstens bezieht sich Molekül auf die Zusammensetzung ähnlicher oder verschiedener Atome, die in Verhältnissen angeordnet sind. Die Moleküle können chemische Verbindungen bilden, die den physikalischen und chemischen Eigenschaften jedes Moleküls unterliegen.
Kurz gesagt bezieht sich eine molekulare Masse auf die Gesamtmasse einer Substanz. Es fasst die durchschnittlichen Massen einzelner Atome in einem Molekül dieser bestimmten Substanz zusammen.
Um die molekulare Masse einer Verbindung X zu bestimmen, müssen Sie die Atommassen aller Elemente in der Zusammensetzung hinzufügen, einschließlich ihrer Multiplikationen gemäß den Unterläufen in der Formel.
Wir werden mit einem Beispiel unten veranschaulichen. Diese Atommassen werden direkt aus der Periodenschaftstabelle der Elemente genommen. Sie werden in Atommasseneinheiten (AMU) gemessen, ebenso die Molekülmasse.
Beispiel 1:
Bestimmen Sie die molekulare Masse von H2O und CH3CH2OH.
Antworten:
Sie müssen die Zusammensetzungen der angegebenen molekularen Formeln bewerten und ihre Atommassen aus der Periodenzüchter abgeleitet. Berücksichtigen Sie die Unterläufe.
Zum Beispiel zeigt H2O an, dass es zwei Wasserstoffatome und ein Sauerstoffatom gibt. Die atomare Wasserstoffmasse stammt aus dem Periodenzüchter 1.0079 AMU und der des Sauerstoffs ist 15.9994. Die molekulare Masse der Verbindung beträgt 2 (1.0079) + 15.9994 = 18.0152 Amu.
Und um die molekulare Masse von Ethanol zu bestimmen, die andere in der Frage angegebene Formel, folgen wir den gleichen Schritten. Es gibt 2 Kohlenstoffatome, 6 Wasserstoffatome und 1 Sauerstoffatom. Die Atommasse des Kohlenstoffatoms beträgt 12.011 Amu. Trotzdem beträgt die molekulare Masse von CH3CH2OH 2 (12.011) + 6 (1.0079) + 1 (15.9994) = 46.069 Amu. Berechnen Sie für Ihre Übung die molekulare Formel von Ethan (C2H4) und CO2.
Was ist Molmasse?
Nun zum Molmassenkonzept ist es als die Masse in Kilogramm oder Gramm eines Substanzs definiert. Normalerweise sind die Einheiten für die Molmasse Gramm/mol. Ein Mol eines Sauerstoffelements hat eine Masse von 15.9994 Gramm. Somit würde die Molmasse 15 sein.9994 g/mol. Für eine Kohlendioxidverbindung ist beispielsweise die Molmasse als die Masse von 1 Mol Molekülen in dieser Verbindung definiert. Avogadros Nummer, 6.022 x 1023 wird häufig verwendet, um die Anzahl von Atomen, Molekülen und anderen Einheiten zu beziehen, denen eine Molmasse gleich ist. Zum Beispiel wäre eine Molmasse von H2O gleich der Masse in Gramm pro Maulwurf von 6.022 x 1023 Wassermoleküle. Wenn dies zu technisch klingt, werden wir mit einem Beispiel unten veranschaulichen:
Beispiel 2:
Bestimmen Sie die Molmasse von Ethanol.
Antworten:
Im ersten Beispiel haben wir die molekulare Masse von Ethanol (C2H5OH) bestimmt. Lassen Sie sich nicht durch eine andere Formel als die oben genannten. Wir haben gerade mit den strukturellen Anordnungen der Ethanolformel herumgespielt, obwohl das Verhältnis von Atomen gleich bleibt.
Ethanol enthält 6.022 x 1023 moleküle, und die Molmasse ist gleich der Masse von Ethanol, die diese Moleküle enthält. Wir fanden, dass die molekulare Masse von Ethanol 46 betrug.069 Atommasseneinheiten in unserem vorherigen Beispiel. Das gleiche Verfahren wird bei der Berechnung der Molmasse befolgt.
Ein Mol Ethanol hat 2 Molkohlenstoffatome, 6 Mol Wasserstoffatome und ein Mol Sauerstoffatom. Wenn wir die Atommassen aus der Zeit Tabelle nehmen, stellen wir fest, dass die Molmasse 2 ist (12.011g) + 6 (1.0079g) + 15.9994g, was gleich 46 ist.069 g/mo. Beachten Sie den gleichen Wert, aber unterschiedliche Einheiten.
NB: Die Molmasse einer chemischen Substanz bezieht sich auf ihre Atommasse oder Molekülmasse in Gramm pro Maulwurf. Die Werte sind die gleichen, aber unterschiedlichen Einheiten.
Übung 2:
Berechnen Sie die Molmasse von Calciumphosphat (CA3 (PO4) 2). Die Antwort sollte 310 sein.177 g/mol.
In Bezug auf Kohlenstoff unterscheidet sich die Molmasse eines natürlich vorkommenden Kohlenstoffs mit demjenigen. Natürlich enthält Kohlenstoff Kohlenstoff-12, Carbon-13 und Carbon-14. Aber ein Mol Kohlenstoff enthält immer noch 6.022 x 1023, aber mit unterschiedlichen Verhältnissen dieser Isotope.
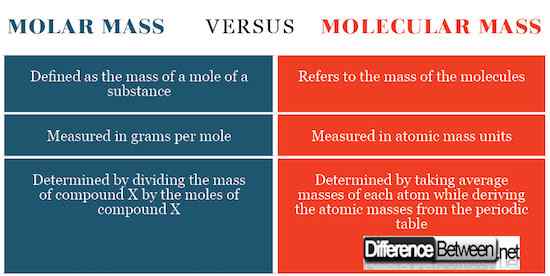
Unterschiede zwischen Molmasse und Molekularmasse
Berechnung für Molmasse und molekulare Masse
Die Molmasse wird durch Teilen der Gesamtmasse der Substanz bestimmt, die die durchschnittliche Masse jedes Atoms durch die Menge in Molen ist. Die resultierende Abbildung beträgt Gramm pro Maulwurf oder Kilogramm pro Maulwurf. Die molekulare Masse wird durch Berechnung der Masse der Substanz im Zusammenhang mit dem 1/12. Carbon-12-Isotop bestimmt.
Definition von Molmasse und molekularer Masse
Die Molekülmasse bezieht sich auf die Masse der Moleküle, während die Molmasse auf die Masse eines Maulwurfs einer Substanz bezieht.
Si -Einheiten für Molmasse und Molekularmasse
Die Molmasse wird als Gramm pro Maulwurf ausgedrückt, während eine Molekülmasse als Atommasseneinheiten ausgedrückt wird. Dieser Ausdruck von Si -Einheiten geht auf die Definition dieser Konzepte als oben genannte zurück.
Zusammenfassung der Molmasse vs. Molekulare Masse
- Molmasse und molekulare Masse sind wichtige Konzepte in der Chemie
- Die Molmasse wird in Gramm pro Maulwurf oder Kilogramm pro Maulwurf exprimiert, während die molekulare Masse in Atommasseneinheiten exprimiert wird. Die Molmasse ist im Grunde genommen uneinheitlich.
- Wir berechnen die Molmasse, indem wir die Masse der Substanz durch die Menge teilen und die molekulare Masse berechnen, indem wir die durchschnittliche Masse der Einheiten der Substanz einnehmen
- Sie haben die gleichen Werte, aber unterschiedliche SI -Einheiten.
- « Unterschied zwischen einem Reisebuch und einer Passkarte
- Unterschied zwischen explizit und implizit »

