Unterschied zwischen Wasserstoffbrückenbindungen und kovalenten Bindungen
- 2121
- 334
- Ines Plank

Das Thema macht sehr deutlich, dass der Artikel auf einigen Konzepten aus der Chemie basiert. Für diejenigen unter Ihnen, die die grundlegenden Konzepte der chemischen Bindung kennen, ist es leicht zu verstehen, dass es in der Diskussion zwei Arten von Bindungen betrifft. Lassen Sie uns nur sagen, dass wir unter den vielen chemischen Bindungen zwischen Atomen und Molekülen zwei sehr wichtige Art von Bindungen diskutieren und unterscheiden werden, nämlich Wasserstoffbrückenbindungen und kovalente Bindungen.
Es ist sehr oft für Menschen, die beiden zu verwirren. Dies liegt an einer vagen Definition, die angeboten wird, um diese relativ zu anderen Art von Bindungen zu erklären. Die einfachste Definition, die angeboten wird. Diese Definitionen sind sehr verallgemeinert und es gibt viele Ausnahmen sowie Widersprüche dafür. Zunächst muss angemerkt werden, dass alle Bindungen zwischen zwei Nichtmetallen nicht unter die Kategorie kovalenter Bindungen fallen. Es gibt auch andere Bindungen, von denen eine eine Wasserstoffbindung ist.
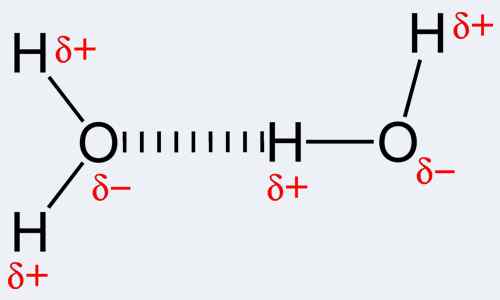
Per Definition ist eine kovalente Bindung eine Form einer chemischen Bindung, die aufgrund des Teilens von Elektronenpaaren zwischen denselben oder unterschiedlichen Atomen auftritt. Die kovalente Bindung bezieht sich wiederum auf das stabile Gewaltbalance (sowohl attraktiv als auch abstoßend) zwischen Atomen, wenn sie Elektronen teilen. Die Freigabe ermöglicht es jedem beteiligten Atom, eine äußere Hülle zu erreichen, die einer vollständigen Valenzschale oder einer äußeren Hülle entspricht. Dies macht eine stabile Konfiguration von Elektronen aus. Im Gegensatz dazu ist eine Wasserstoffbindung tatsächlich der Name der elektrostatischen Anziehungskraft zwischen speziellen Arten von Molekülen, die als polare Moleküle bezeichnet werden. Die Bindung tritt eindeutig auf, wenn ein Wasserstoffatom, das bereits an ein hoch elektronegatives Atom (einer der drei; Sauerstoff, Stickstoff oder Fluor) gebunden ist. Beachten Sie, dass Wasserstoff vorhanden sein muss, damit eine Wasserstoffbindung auftritt, und daher der Name der Bindung. Außerdem sollte einer der drei oben genannten Atome daran gebunden sein. Dies liegt daran, dass Stickstoff, Fluor und Sauerstoff sehr elektronegativ sind, dh Elektronen zu sich selbst anziehen. Dies lässt den Wasserstoff als positiv geladenes Teilchen verhalten, da die negativ geladenen Elektronen dem entsprechenden Stickstoff, Fluor oder Sauerstoffatom angezogen wurden. Daher ist dieses Wasserstoffteilchen, das jetzt positiv ist, aufgrund seiner Negativität leicht zu einem anderen elektronegativen Atom angezogen. Die Verwendung des Namens Wasserstoffbindung für diese chemische Wechselwirkung ist eher wie die Verwendung einer Fehlbezeichnung, da keine echte Bindung gebildet wird. Tatsächlich gibt es DI-Pole bis DI-Pole-Attraktionen.
Die Wechselwirkungen, die in der kovalenten Bindung stattfinden. Es ist in der Tat bemerkenswert, dass die Kovalenz die größte zwischen Atomen ist, die ähnliche Elektronegativitäten aufweisen. Dies impliziert, dass die beiden Atome nicht das gleiche Element haben, sondern eine Elektronegativität haben sollten, die vergleichbar ist und nahe, um stärkere Bindungen zu ermöglichen. Im Gegensatz dazu sind Wasserstoffbrückenbindungen intermolekular, dh zwischen Molekülen oder zwischen verschiedenen Teilen eines Moleküls auftreten. Die Wasserstoffbrückenbindungen sind ziemlich stark; stärker als Van der Waals -Kräfte, sind aber schwächer als kovalente und ionische Bindungen. Beispiele für Moleküle, bei denen eine Wasserstoffbrücke auftritt, umfasst Wasser sowie einige organische Molekulse wie Proteine, DNA usw.
Zusammenfassung der in Punkten ausgedrückten Unterschiede
1. Kovalente Bindung-A-chemische Bindung, die aufgrund des Teilens von Elektronenpaaren zwischen denselben oder unterschiedlichen Atomen auftritt eine äußere Hülle, die einer vollen Valenzschale oder äußerer Hülle entspricht; Eine Wasserstoffbindung ist die elektrostatische Anziehungskraft zwischen speziellen Arten von Molekülen, die als polare Moleküle bezeichnet werden. Die Bindung tritt eindeutig auf, wenn ein Wasserstoffatom bereits an ein hoch elektronegatives Atom (eines der drei; Sauerstoff, Stickstoff oder Fluor) gebunden ist
2. Kovalente Bindung kann zwischen einer Vielzahl von Atomen auftreten; Wasserstoffbrücken benötigen Wasserstoff und einen Sauerstoff, Stickstoff oder Fluor
3. Kovalente Bindung sind stärker als Wasserstoffbrückenbindungen

