Unterschied zwischen galvanischen und elektrolytischen Zellen
- 1713
- 68
- Annelie Auer
Es gibt zwei Arten von elektrochemischen Zellen: galvanische Zellen - mit spontanen Redoxprozessen, die einen kontinuierlichen Elektronenfluss durch den Leiter ermöglichen, wobei die chemische Energie in eine elektrische verwandelt wird; und Elektrolyt, wo die Redoxreaktionen durch eine externe Stromquelle beeinflusst werden, bei der der Strom in chemischer Energie umgewandelt wird.

Was ist galvanische Zelle?
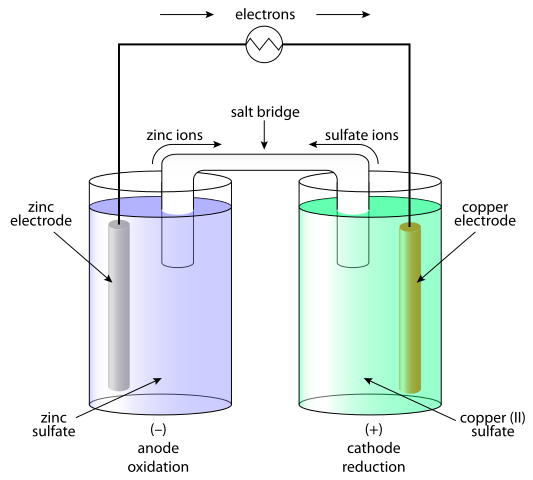
Galvanische Zellen sind Systeme, in denen die chemische Energie in elektrische und infolgedessen erzeugt wird. In galvanischen Zellen wird der Gleichstrom infolge des Redox-Prozessprozesses (Oxidation-Reduktion) erzeugt. Das galvanische Element besteht aus zwei Halbzellen. Die Halbzelle besteht aus dem Elektrolyten und der eingetauchten Elektrode darin. Zwischen diesen Halbzellen muss ein Kontakt zur Verfügung gestellt werden, wobei der Elektrolyt mit einer Salzbrücke oder einer halb leitenden Membran verbunden ist und die Elektrode mit Leiter verbindet. Die Trennung des Redoxprozesses wird durch das Verhalten der Elektroden in Bezug auf den Elektrolyten erklärt. Die einfachste Option ist, dass die Halbzelle aus einer Metallelektrode gebildet wird, die in einen Elektrolyt enthält, der Ionenkorrespondent mit der Elektrode enthält. Das Verhalten von Metallen im Elektrolyten hängt von der Reaktivität des Metalls ab.e. seine Tendenz, sich aufzulösen.
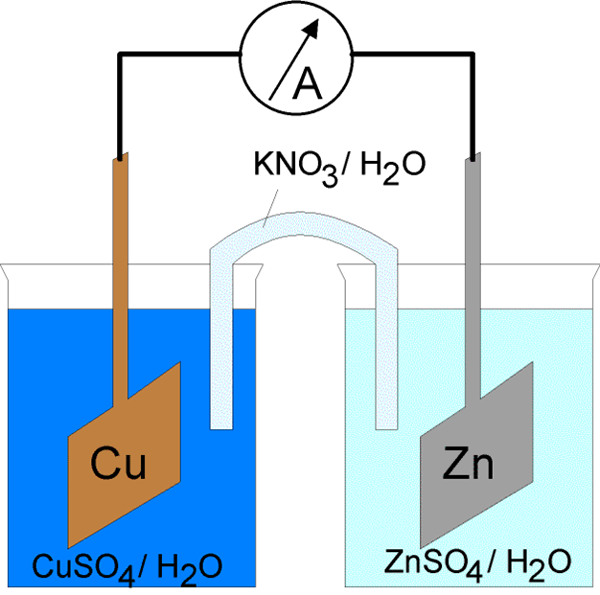
Was ist elektrolytische Zelle?
Der elektrische Strom durch die elektrochemische Zelle kann auf zwei Arten eingeleitet werden. Die erste besteht darin, Elektroden mit einem Leiter an einen geschlossenen elektrischen Stromkreis zu verbinden. Durch Schließen des elektrischen Stromkreises ist es möglich, in beiden Phasen des Metalls/Elektrolyten spontan Elektrodenreaktionen zu induzieren. Darüber hinaus wird die Energie des Stroms auf Kosten der Energie einer spontanen chemischen Reaktion freigesetzt. Eine Zelle, die auf diese Weise funktioniert, wird als galvanische Zelle bezeichnet. Dies wurde oben erklärt. Eine andere Möglichkeit besteht darin, den elektrischen Stromkreis durch serielle Bindung einer externen Stromquelle im Gegensatz zur Spannung der Zelle zu schließen, wobei die externe Spannung größer ist als die elektromotive Kraft der Zelle. Es treibt den Strom in entgegengesetzter Richtung aus der Richtung seines spontanen Flusses durch die Zelle. Aus diesem Grund müssen die Reaktionen der Elektroden in der Zelle der Richtung ihres spontanen Flusses widersprechen. Erzwungene Prozesse in einer elektrochemischen Zelle unter dem Einfluss einer externen elektrischen Stromquelle werden als Elektrolyse bezeichnet, und die elektrochemische Zelle in einer solchen Betriebsweise wird als Elektrolytzelle bezeichnet.
Unterschied zwischen galvanischer und elektrolytischer Zelle
-
Definition von galvanischer und elektrolytischer Zelle
In galvanischen Zellen gibt es spontane Redoxprozesse, die einen kontinuierlichen Elektronenfluss durch den Leiter ermöglichen, wobei die chemische Energie in elektrische Umwandlung umgewandelt wird. In einer elektrolytischen Zelle finden Redoxreaktionen unter dem Einfluss einer externen Quelle statt, bei der der Strom in eine chemische Energie umgewandelt wird. Die Redoxreaktionen sind nicht spontan.
-
Technik der galvanischen und elektrolytischen Zelle
Galvanische Zellen erzeugen Elektrizität mit Hilfe chemischer Reaktionen. In elektrolytischen Zellen wird ein elektrischer Strom für die Entwicklung einer chemischen Reaktion verwendet, wobei eine externe Quelle auf dem Weg verwendet wird.
-
Design von galvanischer und elektrolytischer Zelle
Galvanische Zellen bestehen aus zwei verschiedenen Elektroden, die in Lösungen ihrer Ionen eingetaucht sind, die durch eine semipermeable Membran oder eine Salzbrücke getrennt sind. Elektrolytzellen bestehen aus einem Elektrolytbehälter, in dem zwei Elektroden an eine Gleichstromquelle angeschlossen sind. Der Elektrolyt kann eine Schmelze oder eine wässrige Lösung von Salz, Säure oder Alkali sein.
-
Elektrodenpolarität in galvanischer und elektrolytischer Zelle
In galvanischen Zellen ist die Anode negativ und die Kathode ist die positive Elektrode. In Elektrolytzellen tritt das Gegenteil auf.
-
Chemische Reaktion in galvanischer und elektrolytischer Zelle
Im Falle einer galvanischen Zelle findet die Oxidationsreaktion an der Anode (negative Elektrode) statt, bei der ein überschüssiger negativer Ladung vorliegt. Bei der Kathode tritt die Reduktionsreaktion auf, die einen positiven Anbau von Ladung induziert. Bei Elektrolytzellen wird eine externe Quelle verwendet, um eine Reaktion auszulösen. Bei der negativen Elektrode werden die Elektronen aus der Hand herausgedrückt - so dass die Reduktionsphase auf der negativen Elektrode erfolgt. Auf der positiven Elektrode findet die Oxidationsphase statt - und dies ist die Anode.
-
Anwendung von galvanischer und elektrolytischer Zelle
Galvanische Zellen werden als Quelle für elektrische Strom verwendet und häufiger als Batterien oder Akkumulatoren bezeichnet. Elektrolytische Zellen haben unterschiedliche praktische Verwendungen, von denen einige Wasserstoff- und Sauerstoffgas für kommerzielle und industrielle Anwendungen herstellen, elektroplieren, reine Metalle aus Legierungen und so weiter extrahieren.
Galvanic vs. Elektrolytische Zelle: Vergleich in tabellarischer Form
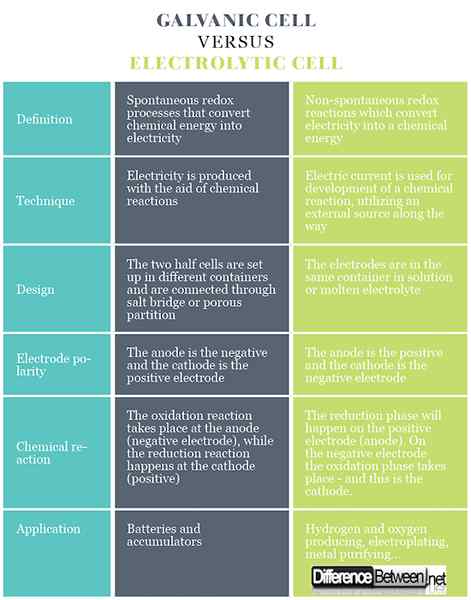
Zusammenfassung von Galvanic vs. Elektrolysezelle
- Eine elektrochemische Zelle besteht aus zwei Halbzellen oder Elektroden, deren Kontakt über einen Elektrolyten (Ionic Leiter) hergestellt wird. Halbzellen können, falls sie getrennt sind, durch eine Salzbrücke (konzentrierte Lösung von Elektrolyten im Agar-Agar-Gel) verbunden werden). Die galvanische Zelle erzeugt einen elektrischen Strom, der auf einer chemischen Veränderung basiert, die spontan darin auftritt. Die elektrolytische Zelle tut genau das Gegenteil: Der Strom führt zu einer chemischen Veränderung. Damit die Zelle galvanisch ist, muss eine spontane chemische Veränderung darin auftreten.

