Unterschied zwischen Elektronengeometrie und molekularer Geometrie
- 4664
- 331
- Leonhard Lesch
Chemie ist das Studium der Materie und befasst sich mit den vielen Möglichkeiten, wie eine Art von Materie in andere Arten umgewandelt werden kann. Es ist bekannt, dass alle Materie aus einem oder mehreren von etwa hundert verschiedenen Arten von Atom bestehen. Alle Atome bestehen aus drei grundlegenden Partikeln - Protonen, Elektronen und Neutronen. Ein Molekül besteht aus einer Gruppe von zwei oder mehr Atomen, die in einem bestimmten geometrischen Muster zusammengehalten werden. Wenn zwei oder mehr Atome stark zusammengehalten werden, um ein Molekül zu bilden, gibt es chemische Bindungen zwischen jedem Atom und seinen engen Nachbarn. Die Form eines Moleküls vermittelt eine Fülle von Informationen und der erste Schritt zum Verständnis der Chemie eines Moleküls besteht darin, seine Geometrie zu kennen.
Die molekulare Geometrie bezieht sich einfach auf die dreidimensionale Anordnung der Atome, die ein Molekül bilden. Die Begriffsstruktur wird eher in gewissem Sinne verwendet, um einfach die Konnektivität der Atome anzuzeigen. Die Form eines Moleküls wird in Bezug auf die Abstände zwischen den atomaren Kernen bestimmt, die miteinander verbunden sind. Die Geometrie von Molekülen wird durch die Vespr-Theorie (Valenzschalen-Elektronenpaar-Abstoßung (. Die Geometrie eines Moleküls wird entweder als Elektronengeometrie oder als molekulare Geometrie angegeben.

Was ist Elektronengeometrie?
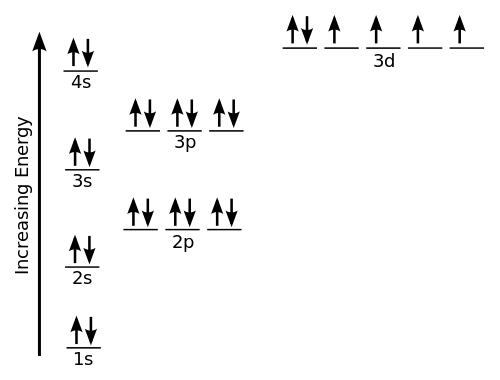
Der Begriff Elektronengeometrie bezieht sich auf den Namen der Geometrie des Elektronenpaars/der Gruppen/Domänen des zentralen Atoms, unabhängig davon. Elektronenpaare werden in Paaren oder Bindungen, einsamen Paaren oder manchmal als einzelner ungepaarter Elektron als Elektronen definiert. Da die Elektronen immer in einer ständigen Bewegung sind und ihre Pfade nicht genau definiert werden können, wird die Anordnung der Elektronen in einem Molekül in Bezug auf eine Elektronendichteverteilung beschrieben. Nehmen wir ein Beispiel für Methan, deren chemische Formel CH ist4. Hier ist das zentrale Atom Kohlenstoff mit 4 Valenzelektronen und 4 Wasserstoff gemeinsame Elektronen mit 1 Kohlenstoff, um 4 kovalente Bindungen zu bilden. Dies bedeutet, dass es insgesamt 8 Elektronen um Kohlenstoff gibt, und es gibt keine einzelnen Bindungen. Es schlägt Ch4 ist tetraedrische Geometrie.
Was ist molekulare Geometrie?
Die molekulare Geometrie wird verwendet, um die Form eines Moleküls zu bestimmen. Es bezieht sich einfach auf die dreidimensionale Anordnung oder Struktur von Atomen in einem Molekül. Das Verständnis der molekularen Geometrie einer Verbindung hilft bei der Bestimmung der Reaktivität, Polarität, Farbe, Phase der Materie und dem Magnetismus. Die Geometrie eines Moleküls wird normalerweise in Bezug auf Bindungslängen, Bindungswinkel und Torsionswinkel beschrieben. Für kleine Moleküle können die molekulare Formel und eine Tabelle mit Standardbindungslängen und -winkeln alles sein, was zur Bestimmung der Geometrie des Moleküls erforderlich ist. Im Gegensatz zur Elektronengeometrie wird es vorhergesagt, indem nur Elektronenpaare berücksichtigt werden. Nehmen wir ein Beispiel für Wasser (h2Ö). Hier ist Sauerstoff (O) das zentrale Atom mit 6 Valenzelektronen, sodass 2 weitere Elektronen von 2 Wasserstoffatomen benötigt werden, um sein Oktett zu vervollständigen. Es gibt also 4 Elektronengruppen, die in einer tetraedrischen Form angeordnet sind. Es gibt auch 2 einzelne Bindungspaare, daher ist die resultierende Form gebogen.
Unterschied zwischen Elektronengeometrie und molekularer Geometrie
Terminologie für Elektronengeometrie und molekulare Geometrie
Der Begriff Elektronengeometrie bezieht sich auf den Namen der Geometrie des Elektronenpaars/der Gruppen/Domänen des zentralen Atoms, unabhängig davon. Es hilft zu verstehen, wie unterschiedliche Elektronengruppen in einem Molekül angeordnet sind. Die molekulare Geometrie dagegen bestimmt die Form eines Moleküls und es ist die dreidimensionale Struktur von Atomen in einem Molekül. Es hilft, das gesamte Atom und seine Anordnung zu verstehen.
Geometrie
Die Geometrie eines Molekül. Es ist die dreidimensionale Form, die ein Molekül im Weltraum einnimmt. Die molekulare Geometrie wird auch als die Positionen der Atomkerne in einem Molekül definiert. Die Elektronengeometrie eines Moleküls dagegen wird auf der Grundlage sowohl von Bindungselektronenpaaren als auch der einzigen Elektronenpaare bestimmt. Die Elektronengeometrie kann unter Verwendung der Vespr -Theorie bestimmt werden.
Beispiele für Elektronengeometrie und molekulare Geometrie
Eines der vielen Beispiele für die tetraedrische Elektronengeometrie ist Ammoniak (NH3). Das zentrale Atom hier ist N und vier Elektronenpaare sind in Form eines Tetraeders mit nur einem einzigen Elektronenpaar verteilt. Somit ist die Elektronengeometrie von NH3 tetraedrisch. Seine molekulare Geometrie ist jedoch trigonaler Pyramiden, da die Bindungswinkel 107 Grad betragen. In ähnlicher Weise die molekulare Geometrie von Wasser (H)2O) ist gebogen, weil es 2 einzelne Bondpaare gibt.
Elektronengeometrie vs. Molekulare Geometrie: Vergleichstabelle

Zusammenfassung der Elektronengeometrie vs. Molekulargeometrie
Sowohl die Elektronengeometrie als auch die molekulare Geometrie folgen dem Vespr-Modell (Valenzschalen-Elektronenpaar-Abstoßung), um die allgemeine Form eines Moleküls basierend auf der Anzahl der Elektronenpaare um ein zentrales Atom zu bestimmen. Die molekulare Geometrie wird jedoch ausschließlich auf der Grundlage von Bindungselektronenpaaren und nicht der Anzahl der Elektronenpaar. Wenn in einem Molekül keine einzigen Elektronenpaare vorhanden sind, entspricht die Elektronengeometrie wie die molekulare Form. Wie gesagt, die Form eines Moleküls sagt viel darüber aus und der erste Schritt zum Verständnis der Chemie eines Moleküls besteht darin, seine Geometrie zu bestimmen.

