Unterschied zwischen Kolloid und Suspension
- 3059
- 82
- Annelie Auer
Dispersionssysteme bestehen aus zwei oder mehr chemischen Verbindungen oder einfachen Substanzen, die als Systemkomponenten bezeichnet werden und untereinander verteilt sind. Sie bilden:
- Dispergierte Phase - die dispergierte Substanz;
- Kontinuierliches Medium - die Substanz, in der die dispergierte Phase verteilt ist.
Abhängig von der Größe der Partikel der Dispersionsphase gibt es:
- Heterogene (raue) Dispersionssysteme - Die Partikel sind größer als 100 nm:
- Federung - eine flüssige und feste Komponente;
- Emulsion - zwei flüssige Komponenten;
- Aerosol - Das Dispersionsmedium ist ein Gas.
- Kolloide - Die Größe der Partikel liegt zwischen 1 und 100 nm;
- Reale Lösungen - Die Partikelgröße beträgt weniger als 1 nm.

Was ist kolloid?
Wasserlösungen vieler Substanzen (Zucker usw.), leicht durch pflanzliche oder tierische semipermeable Barrieren durchlaufen, während andere wie Gelatine nicht durch sie passieren. Die ersten Substanzen werden als Kristalloiden bezeichnet und die zweiten werden als Kolloide bezeichnet.
Abhängig davon, wie sich die Partikel der dispergierten Phase auf das Medium beziehen, sind die Kolloidsysteme:
- Lyophil - adsorbieren Sie eine große Anzahl von Molekülen aus dem Dispersionsmedium (Gelatine, Seifen, Fe (OH)3, Al (OH)3);
- Lyophob - binden oder binden Sie nicht mit einer kleinen Anzahl von Molekülen aus dem Dispersionsmedium (Salze bestimmter Metalle, schlecht lösliche Metallsulfide usw.).
Abhängig von der kolloidischen Partikelstruktur werden die Kolloidsysteme unterteilt in:
- Assoziiert (Mizellar) - Die Partikel sind Gruppen von Atomen, Ionen oder Molekülen (e.G. Natriumchlorid in Benzol);
- Molekular - Die Partikel sind Moleküle einer Verbindung mit einer hohen Molekülmasse (e).G. Stärke).
Abhängig von der Art des Mediums sind die Kolloiden:
- Hydrosole - Das Lösungsmittel ist Wasser;
- Benzenosole - Das Lösungsmittel ist Benzol;
- Etherosole - Das Lösungsmittel ist Ether usw.
Die optischen Eigenschaften der Kolloide manifestieren sich als Färbung, Opaleszenz und Tindalwirkung. Sie sind auf Unterschiede in der Absorption und Dispersion von Licht aus den kolloidalen Partikeln zurückzuführen.
Kolloidale Partikel sind größer und schwerer als die Ionen und die meisten Moleküle, sodass ihre Diffusion und ihr osmotischer Druck niedrig sind.
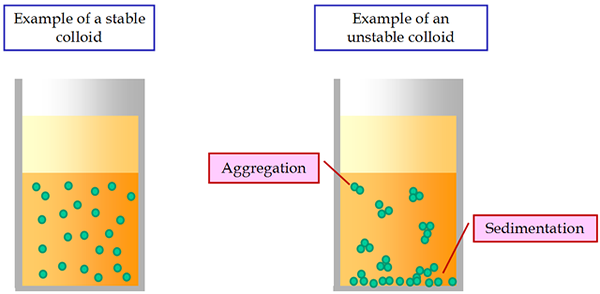
Eine charakteristische kinetische Eigenschaft von Kolloiden ist die Brownsche Bewegung. Die Kolloidsysteme sind weniger stabil als die der gewöhnlichen Lösungen. Unter einem konstanten elektrischen Strom bewegen sich alle Kolloidpartikel zur entsprechenden entgegengesetzt geladenen Elektrode. Dieses Phänomen wird als Elektrophorese bezeichnet.
Sols von molekularen Kolloiden werden analog zu den tatsächlichen Lösungen erhalten. Nach dem Kontakt der Dispersionsphase löst sich spontan im dispergierten Medium. Die Sols assoziierter Kolloide werden durch verschiedene Dispersions- und Kondensationsmethoden erhalten.
- Dispersionsmethoden - Dispersion des Materials auf die Größe der kolloidalen Partikel in Gegenwart eines Dispersionsmediums;
- Kondensationsmethoden - Kondensation (Gruppierung) einzelne Moleküle, Atome oder Ionen in Partikel der Kolloidgröße.
Was ist Suspendierung?
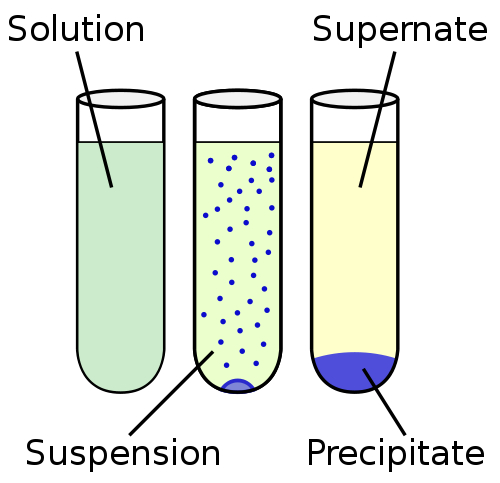
Die Suspension ist eine heterogene Flüssigkeit, die unlösliche feste Partikel enthält, die groß genug sind, um sich abzulegen, aber für einige Zeit sind während des gesamten Volumens der Flüssigmatrix vorhanden. Die Partikel sind größer als 100 nm.
Die Klassifizierung der Suspensionen basiert auf der dispergierten Phase und dem Dispersionsmedium.
Die Suspendierung liegt näher an der Unlöslichkeit im Löslichkeitskontinuum. Am anderen Ende des Löslichkeitskontinuums ist die Lösung, bei der die Partikel vollständig gemischt sind und keine feste Phase beobachtet wird. Das Löslichkeitskontinuum ist im Allgemeinen in der Reihenfolge angeordnet: Unlöslichkeit, Sedimentation, Suspension, Kolloid und Lösung.
Die feste Phase der Suspension wird in der flüssigen Phase durch einen mechanischen Rührprozess mittels eines inerten oder schwach aktiven Wirkstoffs dispergiert. Im Gegensatz zu Kolloiden werden die Suspensionen im Laufe der Zeit gesetzt. Ein Beispiel für eine schnell ausschließende Suspension ist Sand und Wasser.
Eine charakteristische Eigenschaft der Suspensionen ist ihre optische Inhomogenität, die durch Trübung ausgedrückt wird. Trübung ist ein integrales externes Zeichen der Suspension und wird durch das Vorhandensein unlöslicher Partikel bestimmt, die für Licht undurchlässig sind. Der Grad der Trübung der Suspensionen ist unterschiedlich. Es wird durch die Konzentration der suspendierten Phase und den Grad ihrer Dispersion (Partikelgröße) bestimmt.
Eine der wichtigsten Merkmale der Suspensionen ist ihre Sedimentationsinstabilität. Es wird im unvermeidlichen Absetzen von suspendierten Partikeln unter dem Einfluss der Schwerkraft ausgedrückt. Partikel können sich selbst niederlassen, ohne zusammen zu bleiben. In diesem Fall gibt es eine aggregative Stabilität der Suspendierung.
Wenn die Absetzpartikel unter dem Einfluss molekularer Kohäsionskräfte zusammenkleben und Aggregate bilden, gibt es eine aggregative Instabilität von Suspensionen. Somit können sedimentational instabile Suspensionen aggregativ stabil oder instabil sein.
Manchmal werden bei koagulierenden Suspensionen große Flocken gebildet, die durch das Dispersionsmedium schlecht benetzt werden und an der Oberfläche schweben. Dieses Phänomen wird Flockung bezeichnet.
Die Instabilität von Suspensionen in der Praxis von Sedimentation führt zu einer allmählichen Störung der einheitlichen Zusammensetzung vor der vollständigen Ablagerung der unlöslichen Phase.
Es gibt auch Suspensionen, die die Fähigkeit haben, lange Zeit in einem suspendierten Zustand zu bleiben. Sie werden als stabile Suspensionen bezeichnet.
Die Suspensionen werden durch verschiedene Dispersions- und Kondensationsmethoden erhalten.
Unterschied zwischen Kolloid und Suspension
-
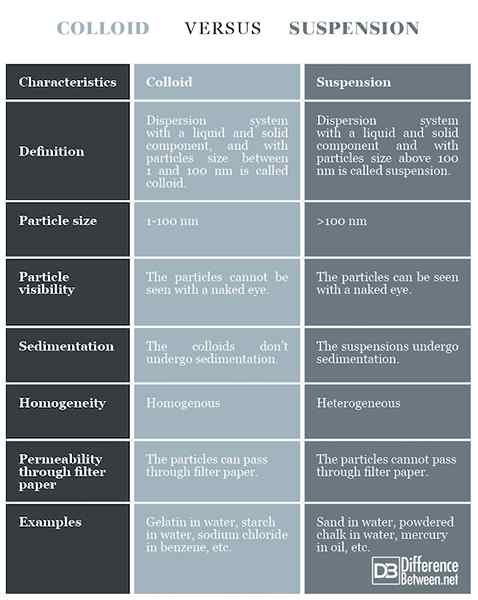
Definition
Kolloid: Dispersionssystem mit einer flüssigen und festen Komponente mit Partikelngröße zwischen 1 und 100 nm wird als Kolloid bezeichnet.
Suspension: Dispersionssystem mit einer flüssigen und festen Komponente, wobei die Partikelgröße über 100 nm als Suspension bezeichnet wird.
-
Partikelgröße
Kolloid: Die Partikelgröße beträgt 1-100 nm.
Suspension: Die Partikelgröße liegt über 100 nm.
-
Partikelsichtbarkeit
Kolloid: Die Partikel im Kolloid können nicht mit bloßem Auge gesehen werden.
Suspension: Die Partikel in der Suspension sind mit bloßem Auge zu sehen.
-
Sedimentation
Kolloid: Die Kolloide werden keine Sedimentation unterzogen.
Suspension: Die Suspensionen werden von einer Sedimentation unterzogen.
-
Homogenität
Kolloid: Die Kolloide sind relativ homogen.
Suspension: Die Suspensionen sind heterogen.
-
Durchlässigkeit durch Filterpapier
Kolloid: Die Kolloidpartikel können durch Filterpapier gelangen.
Suspension: Die Suspensionspartikel können nicht durch Filterpapier gelangen.
-
Beispiele
Kolloid: Gelatine in Wasser, Stärke in Wasser, Natriumchlorid in Benzol usw.
Suspension: Sand in Wasser, Pulverkreide in Wasser, Quecksilber in Öl usw.
Kolloid- und Suspensionsvergleichstabelle
Zusammenfassung von Kolloid und Suspension
- Dispersionssysteme bestehen aus zwei oder mehr chemischen Verbindungen oder einfachen Substanzen, die als Systemkomponenten bezeichnet werden und untereinander verteilt sind. Sie bilden eine dispergierte Phase und ein kontinuierliches Medium.
- Dispersionssystem mit einer flüssigen und festen Komponente mit Partikelngröße zwischen 1 und 100 nm wird als Kolloid bezeichnet.
- Dispersionssystem mit einer flüssigen und festen Komponente, wobei die Partikelgröße über 100 nm als Suspension bezeichnet wird.
- Die Partikel im Kolloid können nicht mit bloßem Auge gesehen werden, während die Partikel in der Aufhängung mit bloßem Auge gesehen werden können.
- Die Kolloide werden keine Sedimentation unterzogen, während die Suspensionen eine Sedimentation unterzogen werden.
- Die Kolloide sind relativ homogen, während die Suspensionen heterogen sind.
- Die Kolloidpartikel können durch Filterpapier gehen, während die Teilchen der Suspensionen nicht können.
- Beispiele für Kolloide sind Gelatine in Wasser, Stärke in Wasser, Natriumchlorid in Benzol usw. Beispiele für Suspensionen sind Sand in Wasser, Pulverkreide in Wasser, Quecksilber in Öl usw.

