Unterschied zwischen cis und trans

- 4344
- 348
- Prof. Dr. Charleen Lammert
CIS-Trans-Isomerismus besteht darin, Substituentengruppen auf einem oder auf verschiedenen Seiten einer Doppelbindungsebene oder eines nicht-aromatischen Zyklus zu platzieren. Cis-trans-Isomere gehören Diastereomeren, da sie keine Spiegelreflexionen voneinander sind. CIS und Trans Isomere sind sowohl bei organischen als auch bei anorganischen Verbindungen zu finden.
Die cis-trans-Nomenklatur beschreibt die relative Position der Ersatzstoffe und liefert keine stereochemische Beschreibung, da die E-Nomenklatur nur für die Alkene anwendbar ist.
Die getrennte Existenz von CIS und Trans -Isomeren ist nur aufgrund der hohen Rotationsbarriere um die Doppelbindung möglich.

Was ist cis?
Das Präfix „cis“ wird vom Latein abgeleitet. Es bedeutet "auf der gleichen Seite". Im CIS-Isomer werden die Substituentengruppen auf einer Seite einer Doppelbindungsebene oder eines nicht-aromatischen Zyklus platziert.
CIS und Trans -Isomere unterscheiden sich in ihren physikalischen Eigenschaften aufgrund der Ungleichheit im Gesamtdipolmoment und der Form der Moleküle.
Der relative Siedepunkt wird durch die Polarität bestimmt. Es verursacht erhöhte intermolekulare Kräfte, was zu einem Anstieg des Siedepunkts führt. Die CIS -Isomere, die polarer sind als die Trans -Isomere, haben einen höheren Siedepunkt. Der Unterschied kann klein sein, da er beispielsweise in den Alkenen mit gerader Kette ist. Größerer Unterschied wird in Substanzen mit polaren Bindungen beobachtet. Beispiel für eine solche Substanz ist das 1,2-Dichlorethen. Der Siedepunkt seines CIS -Isomers beträgt 60.3 ° C und von seinem trans -Isomer - mit 12.8 ° C niedriger. Der Grund für den Unterschied besteht darin. Infolgedessen treten intermolekulare Dipol-Dipolkräfte auf, die den Siedepunkt erhöhen.
Die Symmetrie ermöglicht eine bessere Verpackung der festen Substanzen. Infolge der unterschiedlichen Symmetrie der Moleküle unterscheiden sich die CIS und Trans -Isomere in ihren Schmelzpunkten. Die weniger symmetrischen CIS -Isomere haben einen niedrigeren Schmelzpunkt im Vergleich zu den Trans -Isomeren.
Ein weiteres Merkmal der CIS -Isomere ist, dass sie höhere Dichten haben als ihre Transkollegen.
Normalerweise sind in acyclischen Systemen die CIS -Isomere instabiler als Trans -Isomere. Der Grund dafür ist die Zunahme der ungünstigen sterischen Wechselwirkung der Substituenten in den CIS -Isomeren. Im Allgemeinen haben CIS -Isomere eine höhere Löslichkeit bei inerten Lösungsmitteln.
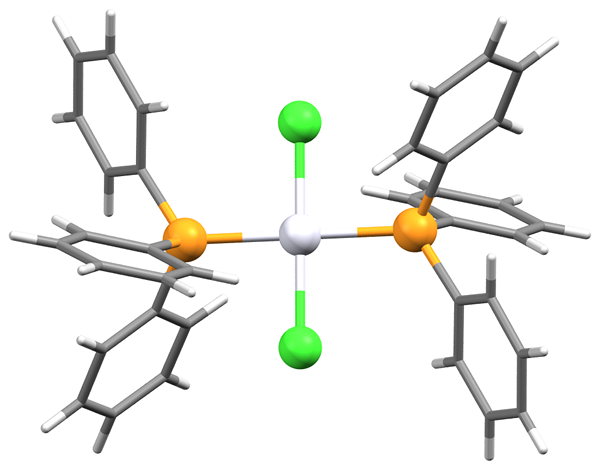
Was ist trans?
Das Präfix "trans" wird vom Latein abgeleitet. Es bedeutet "auf gegnerischen Seiten". Im Trans-Isomer werden die Substituentengruppen auf verschiedenen Seiten einer Doppelbindungsebene oder eines nicht-aromatischen Zyklus platziert.
Der Siedepunkt der Trans -Isomere ist niedriger als in den CIS -Isomeren. Der Unterschied ist bei Substanzen mit polaren Bindungen signifikanter. Im Trans-Isomer von 1,2-Dichlorethen werden sich die beiden C-cl-Bindungsmomente gegenseitig aufsaugen und das Molekül hat einen Netto-Null-Dipol. Infolgedessen gibt es keine intermolekularen Dipol-Dipolkräfte, die den Siedepunkt verringern.
Die Symmetrie der Moleküle ist der Schlüssel bei der Bestimmung des Schmelzpunkts aufgrund der besseren Verpackung der festen Substanzen. Beispiele hierfür sind die Ölsäure (cis Isomer) und Elaidinsäure (Trans Isomer). Der Schmelzpunkt des CIS Isomers beträgt 13.4 ° C schmilzt das Trans -Isomer bei 43 ° C. Der Grund dafür ist, dass das Trans -Isomer gerader ist, besser und daher einen viel höheren Schmelzpunkt aufweist.
Die Trans -Isomere haben niedrigere Dichten als ihre CIS -Kollegen. In acyclischen Systemen sind Trans -Isomere stabiler als cis -Isomere. Im Allgemeinen weisen CIS -Isomere eine höhere Löslichkeit bei inerten Lösungsmitteln auf.
Unterschied zwischen cis und trans
-
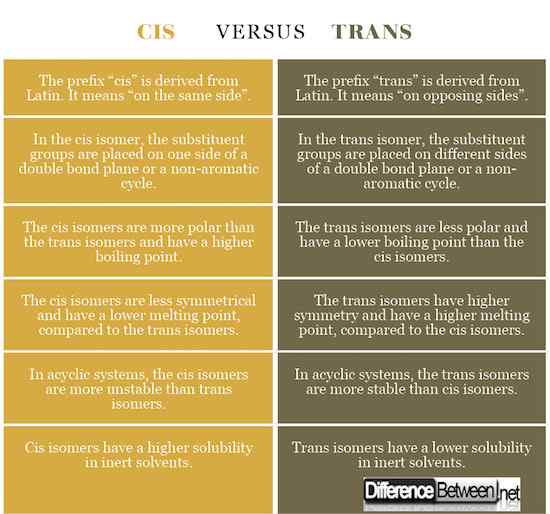
Definition von cis und trans
Cis: Das Präfix „cis“ wird vom Latein abgeleitet. Es bedeutet "auf der gleichen Seite". Im CIS-Isomer werden die Substituentengruppen auf einer Seite einer Doppelbindungsebene oder eines nicht-aromatischen Zyklus platziert.
Trans: Das Präfix "trans" wird vom Latein abgeleitet. Es bedeutet "auf gegnerischen Seiten". Im Trans-Isomer werden die Substituentengruppen auf verschiedenen Seiten einer Doppelbindungsebene oder eines nicht-aromatischen Zyklus platziert.
-
Polarität und Siedepunkt von cis und trans
Cis: Die Polarität verursacht erhöhte intermolekulare Kräfte, was zu einer Erhöhung des Siedepunkts führt. Die CIS -Isomere, die polarer sind als die Trans -Isomere, haben einen höheren Siedepunkt.
Trans: Die Trans -Isomere sind weniger polar und haben einen niedrigeren Siedepunkt als die CIS -Isomere. Der Unterschied ist bei Substanzen mit polaren Bindungen signifikanter.
-
Symmetrie- und Schmelzpunkt von cis und trans
Cis: Die CIS -Isomere sind weniger symmetrisch und haben einen niedrigeren Schmelzpunkt im Vergleich zu den Trans -Isomeren.
Trans: Die Trans Isomere haben eine höhere Symmetrie und einen höheren Schmelzpunkt als die CIS -Isomere.
-
Stabilität und Löslichkeit von cis und trans
Cis: In acyclischen Systemen sind die CIS -Isomere instabiler als Trans -Isomere. Sie haben eine höhere Löslichkeit bei inerten Lösungsmitteln.
Trans: In acyclischen Systemen sind die Trans -Isomere stabiler als cis -Isomere. Sie haben eine geringere Löslichkeit bei inerten Lösungsmitteln.
Zusammenfassung cis vs. Trans:
- CIS-Trans-Isomerismus besteht darin, Substituentengruppen auf einem oder auf verschiedenen Seiten einer Doppelbindungsebene oder eines nicht-aromatischen Zyklus zu platzieren.
- Die getrennte Existenz von CIS und Trans -Isomeren ist nur aufgrund der hohen Rotationsbarriere um die Doppelbindung möglich. Sie sind sowohl unter organischen als auch bei anorganischen Verbindungen zu finden.
- Die Präfixe „cis“ und trans sind vom Latein abgeleitet. CIS bedeutet "auf der gleichen Seite", Trans bedeutet "auf gegnerischen Seiten".
- Im CIS-Isomer werden die Substituentengruppen auf einer Seite platziert, während im trans-Isomer die Substituentengruppen auf verschiedenen Seiten einer Doppelbindungsebene oder eines nicht-aromatischen Zyklus platziert werden.
- Die Polarität verursacht erhöhte intermolekulare Kräfte, was zu einer Erhöhung des Siedepunkts führt. Die CIS -Isomere sind polarer als die Trans -Isomere und haben einen höheren Siedepunkt. Der Unterschied ist bei Substanzen mit polaren Bindungen signifikanter.
- Die CIS -Isomere sind weniger symmetrisch und haben einen niedrigeren Schmelzpunkt im Vergleich zu den Trans -Isomeren.
- In acyclischen Systemen sind die CIS -Isomere instabiler als Trans -Isomere. Sie haben eine höhere Löslichkeit bei inerten Lösungsmitteln.
- « Unterschied zwischen Samsung Galaxy S7 und Galaxy S7 Edge
- Unterschied zwischen Endosmose und Exosmose »