Unterschied zwischen Affinität und Avidität
- 1690
- 441
- Rahel Diedrich
Während die theoretischen Thermodynamik von Antigen-Antikörper-Wechselwirkungen bekannt sind, ist ihre praktische Verwendung bei der Erkennung oder Bestimmung von Autoantikörpern knapp. Bei funktionellen Antikörpern ermöglicht die Bestimmung der optimalen Affinität den maximalen therapeutischen Nutzen. Die Antikörper -Affinität wurde seit fast einem halben Jahrhundert untersucht und hat sich vor drei Jahrzehnten seit der Gründung der Affinitätschromatographie zu einem leistungsstarken Werkzeug entwickelt. Affinität beschreibt die Interaktion in einer einzelnen Bindungsstelle. Die Kenntnis der Affinität sowie der Konstrukt- und Antigeneigenschaften ist für die Bewertung des Zusammenhangs zwischen Affinität und Wirksamkeit für einen funktionellen Antikörper von wesentlicher Bedeutung. Zusätzlich zur Affinität gibt es jedoch ein weiteres Bindungskonzept, das als Avidität bezeichnet wird, nämlich die Gesamtbindungsstärke der Wechselwirkung zwischen einem multivalenten Antigen und einem multivalenten Antikörper. Trotz der klaren Unterschiede zwischen den beiden werden die Begriffe Affinität und Avidität oft wahllos eingesetzt. Schauen wir uns die beiden an.

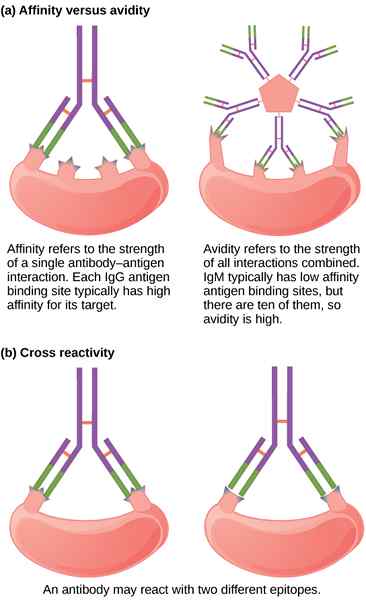
Was ist Affinität?
Affinität ist die Bindung eines Antikörpermoleküls mit seinem entsprechenden Epitop am Antigenmolekül. Es beschreibt die Interaktion in einer einzelnen Bindungsstelle. Die Kenntnis der Affinität sowie der Konstrukt- und Antigeneigenschaften ist für die Bewertung des Zusammenhangs zwischen Affinität und Wirksamkeit für einen funktionellen Antikörper von wesentlicher Bedeutung. Es basiert auf den gleichen thermodynamischen Prinzipien, die jede reversible biomolekulare Wechselwirkung bestimmen, dieselbe Bindungsstärke, die es Ihrem Immunsystem ermöglicht, Infektionen abzuwehren. Und die Stärke bezieht sich auf die Stärke einer spezifischen Bindung zwischen einem Antikörper und seinem Antigen. Genauige und genaue Bewertung der Affinität für eine Antigen-Antikörper-Wechselwirkung ist eine wichtige Messung, um Affinitätsgrenzen und die Potenzdecke für einen therapeutischen Antikörper festzulegen. In thermodynamischen Begriffen wird die Affinität als Summierung aller attraktiven Kräfte ausgedrückt, was zu einer erhöhten Bindungsfestigkeit und abstoßenden Kräften führt, was zu einer verminderten Bindungsfestigkeit führt.
Was ist Avidität??
Avidität ist ein weiteres verbindliches Konzept, das oft mit Affinität verwechselt wird. Tatsächlich beziehen sich beide Begriffe auf das Konzept der Bindungsstärke, außer dass Avidität die Gesamtfestigkeit der Antigenbindungskapazität der Mischung aus polyklonalen Antikörpern bezieht. Die Avidität kommt zum Bild, wenn ein multivalentes Antigen an einen bivalenten Antikörper in Lösung bindet oder wenn ein Antikörper an zwei monovalente Antigenmoleküle auf einer Oberfläche bindet. Im Gegensatz zur Affinität beschreibt Avidität die multivalente Bindung zwischen mehreren Bindungsstellen des Liganden bzw. Ligate. In einfachen Worten ist Avidität die Bindungskraft zwischen einem multivalenten Antikörper und einem multivalenten Antigen. Die Avidität kann nicht durch thermodynamische Begriffe beschrieben werden und wird durch kinetische Messungen erhalten. Die Avidität des Antikörpers hängt von den Affinitäten der einzelnen Antikörperbindungsstellen ab, ist jedoch größer als die Bindungsaffinität, da alle Antikörper-Antigen-Wechselwirkungen gleichzeitig gebrochen werden müssen, damit der Antikörper vollständig dissoziieren kann.
Unterschied zwischen Affinität und Avidität
Definition von Affinität und Avidität
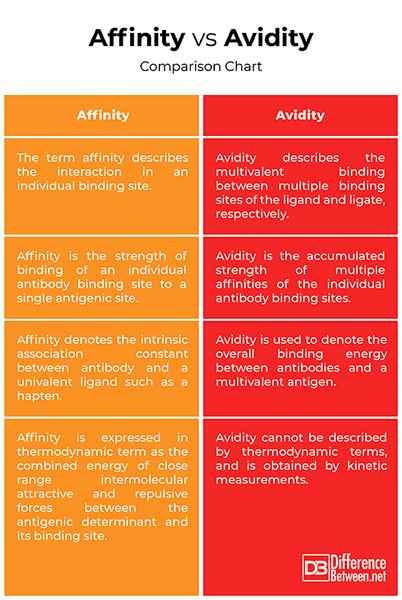
Die Begriffe Affinität und Avidität werden manchmal unangemessen als Synonyme verwendet. Tatsächlich beziehen sich beide Begriffe auf das Konzept der Bindungsstärke. Die Affinität wird thermodynamisch als Messung des Assoziationsgrades zwischen Antikörper und Antigen.Affinität ist die Stärke der Bindung eines Antikörpers, der die Stelle an ein entsprechendes Antigenepitop kombiniert, während die Avidität die Gesamtfestigkeit der Antigen-Bindungskapazität des Gemisches von polyklonalen Antikörpern ist. Die Avidität wird auch als funktionale Affinität bezeichnet.
Auftreten
Der Begriff Affinität bezeichnet die intrinsische Assoziationskonstante zwischen Antikörper und einem einivalenten Liganden wie einem Hapten, während der Begriff Avidität verwendet wird, um die Gesamtbindungsenergie zwischen Antikörpern und einem multivalenten Antigen zu bezeichnen. Die Assoziationskonstante ist ein Maß für die Affinität des Antikörpers für das Epitop. Die Avidität kann nicht durch thermodynamische Begriffe beschrieben werden und wird durch kinetische Messungen erhalten. In thermodynamischen Begriffen wird die Affinität als die Summe der Energie des engen intermolekularen attraktiven und abstoßenden Kräfte zwischen der antigenen Determinanten und seiner Bindungsstelle ausgedrückt.
Biologische Bedeutung
Antikörperaffinität kann eine entscheidende Rolle bei der Bestimmung der biologischen Aktivitäten von Antikörpern spielen. Daher ist es notwendig, eine Antikörperantwort sowohl in Bezug auf Affinität als auch Größe charakterisieren zu können und auch zu verstehen, wie sich die Antikörperaffinität auf einen bestimmten Assay auswirken kann. Der Begriff Avidität wird manchmal synonym mit Affinität verwendet, aber am häufigsten wird die Fähigkeit von Antikörpern beschrieben, stabile Komplexe mit Antigen zu bilden. Avidität ist die akkumulierte Stärke mehrerer Affinitäten der einzelnen Antikörperbindungsstellen.
Affinität vs. Avidität: Vergleichstabelle
Zusammenfassung der Affinität vs. Avidität
Trotz ihrer Unterschiede werden die Begriffe Affinität und Avidität oft wahllos eingesetzt. Affinität ist die Bindung eines Antikörpermolekül -Paratops mit seinem entsprechenden Epitop am Antigenmolekül und kann nur durch ein einzelnes monovalentes Fab -Fragment bestimmt werden. Es ist die Summierung aller attraktiven Kräfte, die zu einer erhöhten Bindungsfestigkeit und abstoßenden Kräften führen, die zu einer verminderten Bindungsfestigkeit führen. Die Avidität hingegen ist die Bindungskraft zwischen einem multivalenten Antikörper und einem multivalenten Antigen und wird auch als funktionale Affinität bezeichnet. Die gemessene Bindungsenergie zwischen Antikörpern und ihren entsprechenden Antigenen spiegelt die Avidität von Antikörpern wider. Im Gegensatz zur Affinität kann die Avidität nicht durch thermodynamische Begriffe beschrieben werden und wird durch kinetische Messungen erhalten.
- « Unterschied zwischen Legierungszehen und Stahlzehen
- Unterschied zwischen Legierung und Verbundflecken »

