Unterschied zwischen adiabatisch, isothermisch und isobarisch
- 4060
- 612
- Cem Schlitzer

Was ist adiabatisch?
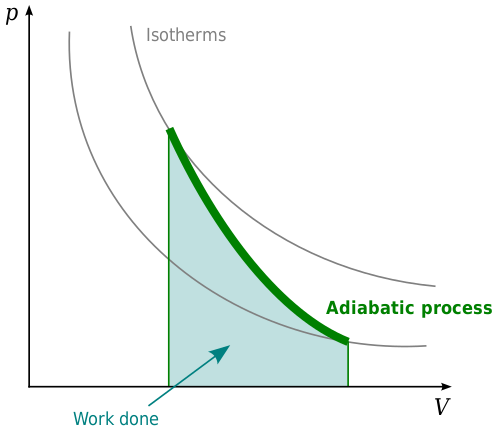
Ein adiabatisches System oder ein adiabatisches Verfahren ist eines, bei dem keine Nettoveränderung der Wärmeenergie vorliegt. Adiabatische Prozesse beziehen sich auf das erste Gesetz der Thermodynamik. Dieses Gesetz besagt, dass bei der Eingabe von Wärmeenergie in ein System entweder die interne Energie des Systems verändert oder funktioniert. Dies hängt mit dem Gesetz der Energieerhaltung zusammen, die besagt, dass Materie und Energie nicht geschaffen oder zerstört werden können. Im Kontext der Thermodynamik muss die Wärmeenergie in einem System etwas tun. Es wird entweder die interne Energie des Systems, die Arbeit oder eine Kombination von beidem verändern. Es kann nicht einfach verschwinden.
In einem adiabatischen System ändert sich Druck, Volumen und Temperatur so, dass die Wärmeenergie konstant bleibt. Adiabatische Prozesse sind am deutlichsten in Gasen zu sehen. Die adiabatische Erwärmung in einem Gas erhöht die Temperatur, wenn der Druck auf das Gas zunimmt. Wenn der Druck auf das Gas abnimmt, fällt die Temperatur ab, was zu einer adiabatischen Kühlung führt. Bei adiabatischer Erwärmung wird das Gas komprimiert und somit die Arbeiten an der Umwelt am Gas erfolgen. Wenn adiabatische Kühlung auftritt.
Ein Beispiel, bei dem adiabatische Prozesse wichtig sind. Mit zunehmender Druck durch den Kolben wird sich das Gas zusammenziehen. Mit Dekompression wird sich das Gas erneut ausdehnen und den Kolben bewegen. Dies wird durch adiabatische Prozesse gesteuert.
Adiabatische Prozesse sind in der Meteorologie wichtig. Wenn ein Luftpaket steigt, nimmt der Druck auf das Luftpaket ab, was dazu führt, dass die Lufttemperatur aufgrund der adiabatischen Kühlung abnimmt. Wenn dagegen eine Luftmasse gegen den Boden gedrückt wird, wird der Druck auf die Luftmasse erhöht, wodurch die Luftmasse erwärmt wird. Da der Luftdruck mit der Höhe abnimmt, nimmt die Temperatur mit der Höhe in der Atmosphäre ab. Die Rate, mit der die Temperatur mit zunehmender Höhe abnimmt.
Was ist isotherm?
Ein isothermischer Prozess ist einer, bei dem die Temperatur auch dann konstant bleibt, wenn sich Druck und Volumen ändern. Druck, Temperatur und Volumen sind in der Thermodynamik mit dem Gasgesetz von Boyle in Verbindung gebracht. Wenn einer konstant gehalten wird, ändern sich die anderen im Verhältnis zueinander zueinander. Wenn die Temperatur eines Gases konstant gehalten wird, ist der Druck und das Volumen des Gases umgekehrt proportional.
Ein Beispiel für einen isothermen Prozess ist eine Phasenänderung. Wenn eine Substanz wie Wasser ihren Schmelzpunkt oder ihren Siedepunkt erreicht, bleiben Druck und Temperatur konstant, wenn die Phase, das Volumen und die Wärmeenergiewechsel sich.
Isotherme Prozesse bilden die Grundlage für Wärmemotoren, die in elektrischen Kraftwerken, Autos, Flugzeugen, Raketen und anderen Maschinen verwendet werden, die für die moderne Zivilisation wichtig sind. Isothermische Prozesse sind auch wichtig in Biologie, Geologie, Weltraumwissenschaft, Planetenwissenschaften und vielen anderen Bereichen.
Was ist isobarisch?
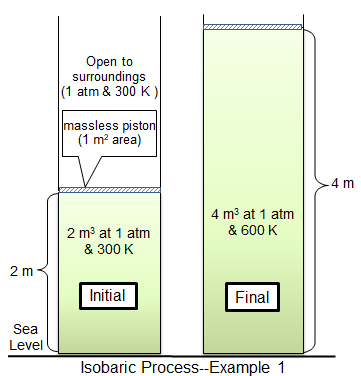
In einem isobaren Prozess bleibt der Druck in einem System konstant. Unter iobarischen Bedingungen stehen Volumen und Temperatur direkt miteinander verbunden. Wenn die Temperatur zunimmt, muss auch das Volumen. Dies kann veranschaulicht werden, indem ein Ballon in einen Gefrierschrank gelegt wird. Der Druck sowohl innerhalb des Ballons als auch nach außen bleibt konstant, aber der Ballon beginnt in Lautstärke zu schrumpfen, wenn er sich abkühlt.
Ein weiteres Beispiel ist ein gewichteter Kolben, der von erhitztem Gas in einem Zylinder bewegt wird. Wenn das Gas erhitzt wird, steigt die Gastemperatur und das Gas dehnt sich aus, was den Kolben drückt. Wenn der Kolben fix.
Isobarische Prozesse sind für den Bau von Wärmemotoren wichtig, da bestimmte Wärmemotoren sich auf isobarische Prozesse verlassen, um Wärmeenergie in mechanische Energie umzuwandeln.
Ähnlichkeiten zwischen adiabatischen Vs. isothermisch vs. isobar
Adiabatische, isotherme und isobarische Prozesse hängen alle mit Druck, Temperatur und Volumen zusammen. Sie sind auch alle mit Gasen am besten illustriert. Alle drei Arten von Prozessen sind auch in Planetenatmosphären am relevantesten.
Unterschiede zwischen adiabatischen vs. isothermisch vs. isobar
Obwohl diese Prozesse Ähnlichkeiten haben, haben sie auch wichtige Unterschiede. Dazu gehören die folgenden.
- Die Temperatur eines Gases nimmt ab, wenn sich das Gas in einem adiabatischen System ausdehnt, während die Temperatur konstant bleibt, wenn sich das Gas in einem isothermen System ausdehnt und zunimmt, wenn sich das Gas in einem isobaren System ausdehnt.
- In einem adiabatischen oder isothermen System ist das Volumen eines Gas umgekehrt proportional zur Temperatur, während es direkt proportional zur Temperatur in einem isobaren System ist.
- Der Druck eines Gases ist umgekehrt proportional zum Volumen in einem isothermen System, während es sich nicht in einem isobaren System ändert und der Druck auf ein Gas umgekehrt proportional zum Volumen in einem adiabatischen System ist.
- Wärme ändert sich nicht in einem adiabatischen System, während es sich in einem isothermen oder isobaren System ändert.
Adiabatische vs. isothermisch vs. isobar

Zusammenfassung
In einem adiabatischen System gibt es keine Wärmeveränderung. Wenn sich ein Gas ausdehnt, sinkt die Temperatur, was zu adiabatischer Kühlung führt. Wenn ein Gas komprimiert ist, steigt die Temperatur, was zu adiabatischer Erheizung führt. Adiabatische Prozesse sind in der atmosphärischen Wissenschaft wichtig. In einem isothermen Prozess ist die Temperatur konstant, und Druck und Volumen sind umgekehrt miteinander verbunden. Ein Beispiel für einen isothermen Prozess ist eine Phasenänderung. Während der Phaseänderung ändert sich die Temperatur einer Substanz nicht, obwohl sich die Wärme und sein Volumen ändern. In einem isobaren System bleibt der Druck konstant und das Volumen nimmt mit der Temperatur zu oder nimmt ab. Wenn beispielsweise ein Gasvolumen in einen Gefrierschrank platziert wird, nimmt das Gasvolumen der Größe ab, da der Druck konstant ist, während seine Temperatur sinkt.

