Unterschied zwischen Essigsäure und Gletscher Essigsäure
- 1183
- 120
- Prof. Dr. Charleen Lammert
Was ist Essigsäure?
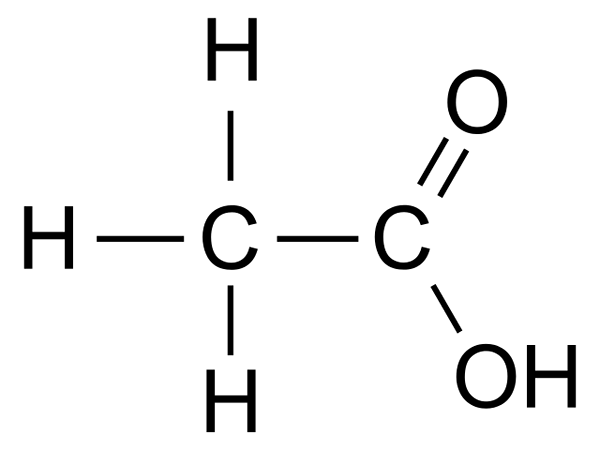
Essigsäure (CH3COOH) ist eine der einfachsten Carbonsäuren. Unter der IUPAC -Systemnomenklatur ist der Name von Essigsäure Ethansäure.
Die Essigsäure wird in Zersetzung und Essiggärtung synthetisiert. In Natur.
In der Vergangenheit wurde Essigsäure durch Essiggärung des im Wein enthaltenen Ethylalkohols erzeugt. Durch die Wirkung von bakteriellen Enzymen wird der Alkohol des Weins durch den Sauerstoff der Luft zu Essigsäure oxidiert.
Industriemethode zur Herstellung von Essigsäure ist die direkte katalytische Oxidation von Acetaldehyd oder Butan. Es kann auch industriell durch Carbonylierung von Methanol produziert werden, die durch Rhodium-Iod katalysiert werden.
Essigsäure ist eine farblose Flüssigkeit mit scharfen Geruch und saurem Geschmack. Es löst sich sehr gut im Wasser auf. Aufgrund der größeren Polarität der Bindung bilden die O-H-Carbonsäuren stärkere intermolekulare Wasserstoffbrückenbindungen als die Alkohole, was die uneingeschränkte Löslichkeit von Essigsäure bestimmt.
Die chemischen Eigenschaften von Essigsäure werden durch ihre Carboxylfunktionsgruppe und durch die Methyleinheit bestimmt. Die Säure beteiligt sich an chemischen Reaktionen mit Bruch der Bindungen in der Carboxylgruppe.
Essigsäure zeigt die typischen chemischen Eigenschaften der organischen Säuren. In Wasserlösung wird die Essigsäure gemäß der Gleichung dissoziiert:
CH3COOH → CH3Coo ¯+ h
Der Grad der elektrolytischen Dissoziation ist signifikant niedriger als der von starken Anorganinsäuren, so dass es Essigsäure ist eine schwache Säure ist. Es reagiert mit hochelektropositiven Metallen, Basioxiden, Basishydroxiden und Salzen schwächerer Säuren. Die erhaltenen Salze werden Acetate (Ethanoate) genannt.
Reaktionen mit Oxiden, Hydroxiden und Salzen brechen die O-H-Bindung in der Carboxylgruppe.
Die Reaktion von Essigsäure mit Alkoholern in Gegenwart starker Säuren wird als Veresterung bezeichnet, sie führt zur Produktion von Estern.
Essigsäure beteiligt.
In Form von Essig werden in der Lebensmittelindustrie und in den Haushalten Essigsäurelösungen (5 bis 18%) verwendet. Essigsäure wird zur Fixierung von fotografischen Filmen verwendet, um Kalziumablagerungen aus Kranaten und Kesseln zu entfernen, um einen Quallenstich usw. zu behandeln usw. Es wird auch als Konservierungsmittel für Silage verwendet, da es das Wachstum von Bakterien und Pilzen hemmt.
Was ist Gletscher Essigsäure?
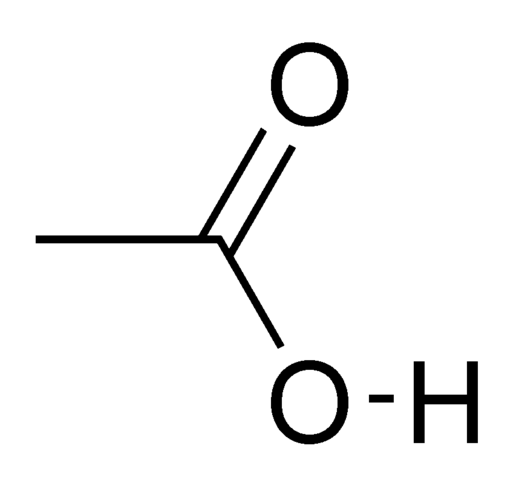
Die reine, wasserfreie Essigsäure ist eine farblose, hygroskopische Flüssigkeit. Bei Temperaturen unter 16.7 ° C bildet es eisähnliche Kristalle. Deshalb wird es als Gletscher Essigsäure bezeichnet.
Die Gletscherlesigsäure kocht bei hoher Temperatur (118 ° C). Grund dafür ist die Bildung stabiler Wasserstoffbrückenbindungen zwischen zwei beliebigen Molekülen von Essigsäure in Form eines zyklischen Dimers. Der Punkt der Entflammbarkeit beträgt 39 ° C. Die Dichte bei 25 ° C beträgt 1.05 g/ml.
Seit Jahrhunderten sind Chemiker der Meinung, dass Gletscher Essigsäure und Säure in Essig zwei verschiedene Substanzen sind.
Die Gletscher Essigsäure ist ätzend und ihre Dämpfe reizen die Augen und die Nase. In Kontakt mit Augen und Haut kann es zu Verletzungen führen.
Nach dem Kontakt von Essigsäure mit kristallisiertem Gletscher Essigsäure ist die reine Essigsäure am Kristall festgehalten.
Die Gletscherlesigsäure ist ein großes polares Basenlösungsmittel. Es wird oft bei der Herstellung von: verwendet:
- Terephthalsäure;
- Propylen Terephthalat;
- Synthetischer Kampfer;
- Anilin.
Unterschied zwischen Essigsäure und Gletscher Essigsäure
-
Definition
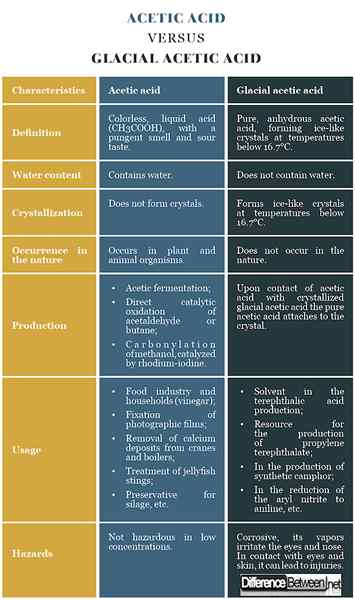
Essigsäure: Die Essigsäure ist eine farblose, flüssige Säure (CH3COOH) mit einem scharfen Geruch und saurem Geschmack.
Eisessig: Die reine, wasserfreie Essigsäure bildet eisähnliche Kristalle bei Temperaturen unter 16.7 ° C, wird als Gletscher Essigsäure bezeichnet.
-
Wassergehalt
Essigsäure: Die Essigsäure enthält Wasser.
Eisessig: Die Gletscher Essigsäure enthält kein Wasser.
-
Kristallisation
Essigsäure: Die Essigsäure bildet keine Kristalle.
Eisessig: Bei Temperaturen unter 16.7 ° C bildet der Gletscher Essigsäure eisähnliche Kristalle.
-
Ereignis in der Natur
Essigsäure: In der Natur kommt die Essigsäure in pflanzlichen und tierischen Organismen vor.
Eisessig: Die reine wasserfreie Essigsäure tritt in der Natur nicht auf.
-
Produktion
Essigsäure: Essigsäure kann durch Essiggärtation, durch direkte katalytische Oxidation von Acetaldehyd oder Butan und durch Carbonylierung von Methanol produziert werden, die durch Rhodium-Iod katalysiert werden.
Eisessig: Nach dem Kontakt von Essigsäure mit kristallisiertem Gletscher Essigsäure ist die reine Essigsäure am Kristall festgehalten.
-
Verwendung
Essigsäure: Die Essigsäure wird in der Lebensmittelindustrie und in den Haushalten (Essig) verwendet; zur Fixierung fotografischer Filme; Kalziumablagerungen von Kranen und Kesseln entfernen; einen Quallenstich, als Konservierungsmittel für Silage usw. zu behandeln, usw.
Eisessig: Die Gletscher Essigsäure wird zur Herstellung von Terephthalsäure, Propylen -Terephthalat, synthetischer Kampfer, Anilin usw. verwendet.
-
Gefahren
Essigsäure: Die Essigsäure ist in niedrigen Konzentrationen nicht gefährlich.
Eisessig: Die Gletscher Essigsäure ist ätzend und ihre Dämpfe reizen die Augen und die Nase. In Kontakt mit Augen und Haut kann es zu Verletzungen führen.
Unterschied zwischen Essigsäure und Gletscher Essigsäure: Vergleichstabelle
Zusammenfassung von Essigsäure gegen Gletscher Essigsäure
- Die Essigsäure ist eine farblose, flüssige Säure (CH3COOH) mit einem scharfen Geruch und saurem Geschmack.
- Die reine, wasserfreie Essigsäure bildet eisähnliche Kristalle bei Temperaturen unter 16.7 ° C, wird als Gletscher Essigsäure bezeichnet.
- Die Essigsäure enthält Wasser, während die Gletscher Essigsäure nicht der Fall ist.
- Die Essigsäure bildet keine Kristalle, während bei Temperaturen unter 16.7 ° C bildet der Gletscher Essigsäure eisähnliche Kristalle.
- In der Natur kommt die Essigsäure in pflanzlichen und tierischen Organismen vor. Die reine wasserfreie Essigsäure tritt in der Natur nicht auf.
- Essigsäure kann durch Essiggärtation, durch direkte katalytische Oxidation von Acetaldehyd oder Butan und durch Carbonylierung von Methanol produziert werden, die durch Rhodium-Iod katalysiert werden. Nach dem Kontakt von Essigsäure mit kristallisiertem Gletscher Essigsäure ist die reine Essigsäure am Kristall festgehalten.
- Die Essigsäure wird in der Lebensmittelindustrie und in den Haushalten (Essig) verwendet; zur Fixierung fotografischer Filme; Kalziumablagerungen von Kranen und Kesseln entfernen; einen Quallenstich zu behandeln; als Konservierungsmittel für Silage usw.
- Die Gletscher Essigsäure wird zur Herstellung von Terephthalsäure, Propylen -Terephthalat, synthetischer Kampfer, Anilin usw. verwendet. usw.
- Die Essigsäure ist in niedrigen Konzentrationen nicht gefährlich. Die Gletscher Essigsäure ist ätzend und ihre Dämpfe reizen die Augen und die Nase. In Kontakt mit Augen und Haut kann es zu Verletzungen führen.

