Verbindung vs. Element
- 1205
- 34
- Fr. Fine Zschunke
Elemente Und Verbindungen sind reine chemische Substanzen, die in der Natur vorkommen. Der Unterschied zwischen einem Element und einer Verbindung ist, dass ein Element eine Substanz aus derselben Art von Atomen ist, während eine Verbindung aus verschiedenen Elementen in eindeutigen Anteilen besteht. Beispiele für Elemente Einbeziehen Eisen, Kupfer, Wasserstoff und Sauerstoff. Beispiele für Verbindungen Wasser einschließen (h2O) und Salz (Natriumchlorid - NaCl).
Elemente sind gemäß ihrer Atomnummer auf der Periodenzüchtertabelle aufgeführt. Unter den 117 bekannten Elementen treten 94 natürlich wie Kohlenstoff, Sauerstoff, Wasserstoff usw. auf. 22 werden künstlich produziert, nachdem sie radioaktive Veränderungen unterzogen wurden. Der Grund dafür ist ihre Instabilität, durch die sie sich über einen bestimmten Zeitraum hinweg radioaktiver Zerfall unterziehen, was zu neuen Elementen während des Prozesses wie Uran, Thorium, Wismut usw. führt. Elemente verbinden sich in festen Verhältnissen und führen aufgrund chemischer Bindungen zu stabilen Verbindungen, die die Bildung von Verbindungen erleichtern.
Vergleichstabelle
| Verbindung | Element | |
|---|---|---|
| Definition | Eine Verbindung enthält Atome verschiedener Elemente, die chemisch in einem festen Verhältnis miteinander kombiniert wurden. | Ein Element ist eine reine chemische Substanz aus derselben Art von Atom. |
| Komposition | Verbindungen enthalten unterschiedliche Elemente in einem festen Verhältnis, das auf definierte Weise durch chemische Bindungen angeordnet ist. Sie enthalten nur eine Art Molekül. Elemente, die die Verbindung bestehen, werden chemisch kombiniert. | Elemente enthalten nur einen Atomtyp. Jedes Atom hat die gleiche Atomzahl I.e., Die gleiche Anzahl von Protonen in ihrem Kern. |
| Fähigkeit, zusammenzubrechen | Eine Verbindung kann durch chemische Methoden/Reaktionen in einfachere Substanzen unterteilt werden. | Elemente können durch chemische Reaktionen nicht in einfachere Substanzen unterteilt werden. |
| Darstellung | Eine Verbindung wird unter Verwendung ihrer chemischen Formel dargestellt, die die Symbole ihrer Bestandteile und die Anzahl der Atome jedes Elements in einem Molekül der Verbindung darstellt. | Ein Element wird unter Verwendung von Symbolen dargestellt. |
| Typen | Eine riesige, praktisch unbegrenzte Anzahl chemischer Verbindungen kann erzeugt werden. Verbindungen werden in molekulare Verbindungen, ionische Verbindungen, intermetallische Verbindungen und Komplexe eingeteilt. | Es gibt ungefähr 117 Elemente, die beobachtet wurden. Kann als Metall, Nicht-Metal oder Metalloid klassifiziert werden. |
| Beispiele | Wasser (H2O), Natriumchlorid (NaCl), Natriumbicarbonat (NAHCO3) und Salzsäure (HCl) sind Beispiele für Verbindungen. | Wasserstoff (H), Sauerstoff (O), Natrium (Na), Chlor (Cl), Kohlenstoff (C), Eisen (Fe), Kupfer (Cu), Silber (AG) und Gold (AU) sind Beispiele für Elemente. |
Unterschiede in den Eigenschaften
Elemente unterscheiden sich durch ihren Namen, Symbol, Atomzahl, Schmelzpunkt, Siedepunkt, Dichte und Ionisationsenergien. In der Periodenzüchter werden Elemente nach ihrer Atomzahl angeordnet und nach ähnlichen chemischen Eigenschaften gruppiert und durch ihre Symbole dargestellt.
- Ordnungszahl - Die Atomnummer wird durch den Brief bezeichnet Z und ist die Anzahl der Protonen, die im Kern des Atoms des Elements vorhanden sind. Für e.G. Carbon hat 6 Protonen in seinem Kern und für Kohlenstoff, z = 6. Die Anzahl der Protonen zeigt auch eine elektrische Ladung oder die Anzahl der im Kern vorhandenen Elektronen, die die chemischen Eigenschaften des Elements bestimmt.
- Atommasse - der Buchstabe A zeigt die Atommasse des Elements an, die die Gesamtzahl der Protonen und Neutronen im Kern eines Atoms des Elements ist. Isotope derselben Elemente unterscheiden sich in ihren Atommassen.
- Isotope - Isotope eines Elements haben die gleiche Anzahl von Protonen in ihrem Kern, unterscheiden sich jedoch in der Anzahl der Neutronen. Natürlich vorkommende Elemente haben mehr als ein stabiles Isotop. Daher haben Isotope ähnliche chemische Eigenschaften (aufgrund der gleichen Anzahl von Protonen), aber unterschiedlichen Kerneigenschaften (aufgrund unterschiedlicher Anzahl von Neutronen). Für e.G. Carbon hat drei Isotope, Kohlenstoff - 12, Kohlenstoff -13 und Kohlenstoff - 14.
- Allotrope - Atome eines Elements können Bindungen in mehr als einer Weise miteinander bilden, was zu einem Unterschied in ihren chemischen Eigenschaften führt. Für e.G. Kohlenstoffbindungen in einem Tetraeder, um Diamant und Sechstenschichten von Kohlenstoffformen zu bilden, bildet Graphit.
Verbindungen bestehen aus verschiedenen Elementen in einem festen Verhältnis. Beispiel. Die Elemente in einer Verbindung behalten nicht immer ihre ursprünglichen Eigenschaften und können nicht durch physikalische Mittel getrennt werden. Die Kombination von Elementen wird durch ihre Valenz erleichtert. Die Valenz ist definiert als die Anzahl der benötigten Wasserstoffatome, die sich mit einem Atom des Elements kombinieren können, das die Verbindung bildet. Die meisten Verbindungen können als Feststoffe (niedrig genug Temperaturen) existieren und durch die Anwendung von Wärme zersetzt werden. Manchmal sind ausländische Elemente in der Kristallstruktur von Verbindungen eingeschlossen, die ihnen eine nicht homogene Struktur geben. Verbindungen werden durch ihre chemische Formel dargestellt, die dem Bergsystem folgt, in dem zuerst Kohlenstoffatome aufgeführt sind, gefolgt von Wasserstoffatomen, wonach Elemente in alphabetischer Reihenfolge aufgeführt sind.
Visualisieren der Unterschiede
Dieses Bild zeigt die Unterschiede zwischen Elementen und Verbindungen auf Atomebene. Elemente haben nur 1 Atometyp; Verbindungen haben mehr als 1. Elemente und Verbindungen sind beide Substanzen; Sie unterscheiden sich von Gemischen, in denen sich verschiedene Substanzen miteinander vermischen.
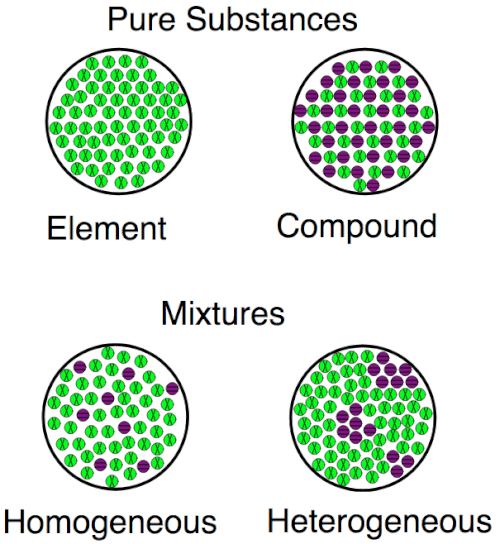 Eine Visualisierung für die Unterschiede zwischen Elementen, Verbindungen und Gemischen, sowohl homogen als auch heterogen.
Eine Visualisierung für die Unterschiede zwischen Elementen, Verbindungen und Gemischen, sowohl homogen als auch heterogen. Geschichte von Elementen und Verbindungen
Elemente wurden ursprünglich als Hinweis auf jeden Zustand der Materie wie Flüssigkeit, Gas, Luft, Feststoff usw. verwendet. Indische, japanische und griechische Traditionen beziehen sich auf fünf Elemente, nämlich Luft, Wasser, Erde, Feuer und Äther. Aristoteles konzipierte ein neues fünfter Element namens "Quintessenz" - das offenbar den Himmel bildete. Während der Forschung ebnete viele bedeutende Wissenschaftler den Weg für das aktuelle Verständnis und die Beschreibung von Elementen. Unter ihnen sind die Arbeit von Robert Boyle, Antoine Lavosier, Dmitri Mendeleev besonders bemerkenswert. Lavoizier war der erste, der eine Liste chemischer Elemente erstellte, und Mendeleev arrangierte die erste, die Elemente nach ihrer Atomzahl in der Periodenzüchttabelle anordnete. Die aktuellste Definition eines Elements wird durch die von Henry Moseley durchgeführten Studien vergeben.
Vor dem 19. Jahrhundert die Nutzung der Laufzeit Verbindung könnte auch eine Mischung bedeuten. Im 19. Jahrhundert konnte eine Verbindung von einer Mischung unterschieden werden. Alchemisten wie Joseph Louis Proust, Dalton und Berthollet, und ihre Studien zu verschiedenen Verbindungen haben die moderne Chemie die aktuelle Definition von Verbindung gegeben. Prousts Arbeit demonstrierte der Welt der Chemie, dass Verbindungen ständige Zusammensetzung der jeweiligen Elemente gemacht wurden.
CAS-Nummer
Jede chemische Substanz wird durch ihre eindeutige numerische Kennung identifiziert - die CAS (Chemical Abstracts Service) Zahl. Daher hat jede chemische Verbindung und jedes Element eine CAS -Zahl. Auf diese Weise sucht die Datenbank nach Elementen und Verbindungen bequemer.

