Anion vs. Kation

- 869
- 242
- Leonhard Lesch
Ein Ion ist ein Atom oder eine Gruppe von Atomen, bei denen die Anzahl der Elektronen nicht der Anzahl der Protonen entspricht, was ihm eine positive oder negative elektrische Netto -Ladung ergibt. Ein Anion ist ein ion, das negativ geladen wird und von der Anode (positive Elektrode) in der Elektrolyse angezogen wird. A Kation hat eine positive Nettoladung und wird während der Elektrolyse von der Kathode (negative Elektrode) angezogen.
Vergleichstabelle
| Anion | Kation | |
|---|---|---|
| Definition | Ein Anion ist ein Atom oder ein Molekül, das negativ geladen wird, ich.e. hat mehr Elektronen als Protonen. | Ein Kation ist ein Atom oder ein Molekül, das positiv geladen wird, ich.e. hat mehr Protonen als Elektronen. |
| Aufladung | Negativ | Positiv |
| Beispiele | (O2-), Sulfid (S2-), Fluorid (F-), Chlorid (Cl-), Bromid (BR-), Iodid (I-), Nitrid (N3-) und Hydrid (H-) | Natrium (Na+), Eisen (Fe2+) und Blei (PB2+) |
| Etymologie | Das griechische Wort ano (up) | Das griechische Wort Kata (Down) |
| Elektrode während der Elektrolyse angezogen | Anode | Kathode |
| Art des Elements | ein Nichtmetall | ein Metall |
Etymologie

Anion stammt aus dem griechischen Wort Ano, bedeutet "up". Das Wort Kation stammt aus seinem griechischen Gegenstück Kata, was bedeutet "unten".
Mnemonisches Gerät
Eine gute Möglichkeit, sich daran zu erinnern, welche Art von Ion positiv aufgeladen ist, besteht darin, die folgenden mnemonischen Geräte zu verwenden:
- Anion: A Negativ ION
- Kation: pawsitiv (Katzen haben Pfoten)
Ladung Bildung
Wenn ein Kationen wie Natrium als (Na+) dargestellt wird, zeigt die '+' Ladung, die sie begleitet. Diese ungleiche Gleichung von Elektronen und Protonen ermöglicht es Natrium, eine positive Ladung zu haben. Wenn das Chloridanion mit (Cl-) dargestellt wird. Wenn das Zeichen ' +' oder das ' -' Zeichen von einer Zahl wie +4 oder -2 begleitet wird, bedeutet dies: Das Kation mit +4 Ladung hat 4 weniger Elektronen als die Gesamtzahl der Protonen und das Anion mit -2 Die Ladung hat zwei weniger Protonen als die Gesamtzahl der Elektronen.
Fesseln
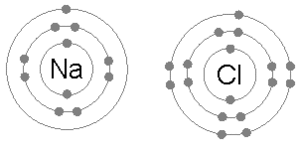 Natrium- und Chlorbindung ionisch zur Bildung von Natriumchlorid.
Natrium- und Chlorbindung ionisch zur Bildung von Natriumchlorid. Anionen und Kationen bilden normalerweise Bindungen. Diese sind als ionische Bindungen bekannt und existieren aufgrund der gegenseitigen Anziehungskraft entgegengesetzt geladener Ionen. Sie bilden eine Kristallbindung, in der entgegengesetzt geladene Ionen aneinander gebunden sind.
Beispiele
Beispiele für Anionen umfassen Oxid (O2-), Sulfid (S2-), Fluorid (F-), Chlorid (Cl-), Bromid (BR-), Iodid (I-), Nitrid (N3-) und Hydrid (H- ).
Zu den Kationenbeispielen gehören Natrium (Na+), Eisen (Fe2+) und Blei (PB2+)

